小文研学旅行时,对“自热米饭”发热包的发热现象感到好奇。返校后,利用化学实验室中已有的生石灰、活性炭、铁粉、碳酸钠、氯化钠、硫酸钠中的若干种物质自制了一个发热包。发现使用自制发热包时,可迅速升温,还可保温较长时间。
小静同学对小文同学自制发热包的成分进行探究。
【实验探究】
小静取适量自制发热包中的固体放入盛有水的烧杯中,迅速放出大量的热,她认为是固体样品中的生石灰与水发生反应产生了热量。为了进一步确认发热包中物质的成分,小静把烧杯中的物质过滤,得到滤液A和滤渣B。
|
实验步骤 |
实验操作 |
实验现象 |
分析与结论 |
|
① |
取适量滤渣B放入烧杯中 |
观察到滤渣B慢慢出现红棕色固体,触摸烧杯外壁感到微热并持续了较长时间 |
红棕色固体是 |
|
② |
取适量滤液A放入试管中,加入过量的氯化钡溶液 |
有白色沉淀生成 |
发热包中除含有生石灰外,一定还含有的物质是 |
|
③ |
取②中的白色沉淀放入试管中,加入足量的稀硝酸 |
白色沉淀全部溶解,有气泡产生 |
|
|
④ |
取②反应后的上层清液放入试管中,先加入足量稀硝酸,再滴入适量 溶液 |
有白色沉淀生成 |
|
|
⑤ |
取适量滤渣B放入试管中,加入足量的稀盐酸 |
固体部分溶解,溶液呈浅绿色,有气泡产生 |
【反思与交流】
(1)步骤②反应后的上层清液中含有的离子共有 种。
(2)步骤④中生成白色沉淀的化学方程式是 。(任写一个)
(3)发热包中的物质使用前必须 保存,使用后注意合理回收。
某化学课外兴趣小组探究氢气还原氧化铜的反应,有如下实验装置:
⑴上述A装置可用于实验室制取氢气和二氧化碳,请分别写出实验室制取氢气和二氧化碳的化学方程式;。
⑵请你参与探究氢气还原氧化铜得到的红色固体的成分,完成下列各题:
已知信息:Ⅰ.Cu和Cu2O均为不溶于水的红色固体;Ⅱ.Cu2O+H2SO4=CuSO4+Cu+H2O
提出问题:红色固体含有什么物质?
①猜想假设:
假设一:红色固体只含有Cu;假设二:红色固体只含Cu2O;
假设三:(请补充完成假设三)。
②实验探究:(填写表中空格)
| 实验操作 |
实验现象 |
实验结论 |
| a.取少量红色固体加入到足量硫酸溶液中 |
无明显现象 |
假设成立 |
| b.取少量红色固体加入到足量硫酸溶液中 |
假设二和假设三均成立 |
③数据处理:甲同学称取Wg红色固体加入到足量硫酸溶液中使其充分反应后,(填操作名称)、洗涤、干燥,称量剩余红色固体质量为mg,通过计算,若m  (选填>、<或=),则假设二成立;若m
(选填>、<或=),则假设二成立;若m  (选填>、<或=),则假设三成立。
(选填>、<或=),则假设三成立。
④交流与反思:只要假设合理,实验方法正确,根据实验现象和数据就能得出结论。
小林、小军和小明在实验室用右图装置做CaCO3受热分解的实验,加热一段时问后,他们对试管内固体的成分进行探究。
【提出问题】加热CaCO3后试管内的固体成分是什么?
【建立假设】小林的假设:CaCO3未分解,固体成分为CaCO3;
小军的假设:CaCO3完全分解,固体成分为;
小明的假设:CaCO3部分分解,固体成分为。
【收集证据】(1)小军取少量固体于试管中,加适量水振荡后静置,再滴
几滴无色酚酞试液,溶液变红。可知小军加水时发生反应的
化学方程 式为————————。
(2)小明向小军实验后的试管中滴加过量稀盐酸,发现有气泡生成。
【获得结论】通过实验可知的假设是成立的。
【交流与评价】实验结束后,在组内交流讨论过程中部分同学提出:在实验中若增加下列仪器中的(填编号)就可以直接根据实验现象判断CaCO3是否分解。
小军同学在学习酸碱盐有关知识时,对一些沉淀物质的颜色产生了兴趣。老师告诉他氢氧化铜是蓝色、氢氧化铁是红褐色,让他自己探究氢氧化亚铁的颜色。下面请你和他一起探究。
[查阅资料]
(1)铁有两种氢氧化物,它们可以分别由相对应的可溶性盐与碱溶液反应而制得。
(2)氢氧化亚铁在空气中立即被氧化。
(3)硫酸铜溶液是蓝色,硫酸亚铁溶液是浅绿色。
[提出猜想]
氢氧化亚铁是浅绿色。
[实验过程]
在2支试管里分别加入少量FeCl3和FeSO4溶液,然后滴入NaOH溶液,观察现象。请补充完成下表:
| FeCl3溶液 |
FeSO4溶液 |
|
| 滴入NaOH溶液的现象 |
生成红褐色沉淀 |
先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色沉淀。 |
化学方程式 |
基本反应类型属于 反应。 |
FeSO4+2NaOH = Fe(OH)2↓+Na2SO4 Fe(OH)2 + + H2O = (完成并配平此方程) |
[学习交流]
(1)氢氧化亚铁是色而不是浅绿色。
(2)小军联系到CO2与C的反应,认为FeCl3溶液可以转化为FeCl2溶液。你认为小军的理由是。
小华同学用排水法收集了一大瓶沼气池中气体(图1中的A),为了弄清它的成分,进行了有关实验。请你与他一起完成以下探究活动:
【对气体猜想】猜想I:全部是CH4;猜想Ⅱ:全部是CO;
猜想Ⅲ:是CO和CO2的混合气体;猜想Ⅳ:是CH4和CO2的混合气体。
【实验和推断】将A中的气体依次通入B、C中,在D处点燃。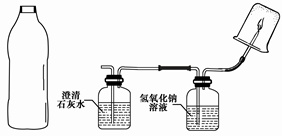

A B C D①②③
图1图2
(1)要将A中的气体通入后面的装置中,应选图2中的(填序号)“注水装置”。
(2)若B中石灰水变浑浊,则说明A中的气体中含有气体。
(3)装置C作用是。
(4)若D处倒扣的是涂有澄清石灰水的烧杯,出现浑浊,且B中无明显现象,则“猜想”可能成立;若D处倒扣的是干冷的大烧杯,杯壁有水雾出现,有同学认为“猜想I、Ⅳ”可能成立,另有同学认为此现象不能证明收集到的气体中一定含有CH4,理由是
;要排除这种干扰可采取的措施是
。
(5)采取(4)中的排除干扰措施后:若D处分别倒扣干冷的烧杯和涂石灰水的烧杯,分别出现水雾和浑浊,且B中也出现浑浊,则证明“猜想”成立。
某同学对“菠菜中富含可溶性草酸盐和碳酸盐,与豆腐同食会引起结石”的说法产生了兴趣。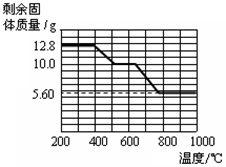
探究一:菠菜里是否含有可溶性草酸盐和碳酸盐?
【查阅资料】
①可溶的草酸盐、碳酸盐能与CaCl2溶液反应生成难溶于水的草酸钙(CaC2O4)、碳酸钙。
②醋酸(化学式用HAc表示)不与草酸钙反应,但能与碳酸钙反应生成可溶性盐。
【实验流程】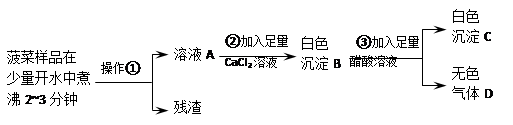
根据流程回答问题:
(1)操作①的名称是_____。
(2)加入足量CaCl2溶液的目的是_____。
(3)已知气体D能使澄清石灰水变浑浊,步骤③中发生反应的化学反应方程式为____
_。
【实验结论】菠菜里含有可溶性草酸盐和碳酸盐。
探究二:不同温度下,草酸钙分解的产物是否相同?
已知下列事实:
①草酸钙高温完全分解得到两种气态氧化物和一种固态氧化物。
②12.8 g的草酸钙分解过程中温度与剩余固体的质量关系如右图所示。
根据上述事实,回答下列问题:
(4)草酸钙高温完全分解的化学方程式为_____。
(5)通过上图数据分析,400℃-500℃发生反应的化学方程式是
_;700℃时剩余固体的成分是____。