学习复分解反应后,某化学兴趣小组的同学对初中化学常见的四种物质稀盐酸、 粉末、 溶液、 溶液之间的反应进行如图所示的实验探究。

(1)大家一致认为试管①中不发生复分解反应,理由是 。
(2)试管②中观察到的现象是 。试管③中发生反应的化学方程式为 。
(3)将试管③反应后的物质过滤,对滤液中溶质的成分进一步探究:
【提出问题】滤液中溶质的成分是什么?
【猜想假设】猜想一:
猜想二: 、
猜想三:
【设计实验】
|
实验操作 |
实验现象 |
结论 |
|
步骤一:取少量滤液于试管中,加入适量 溶液 |
无明显现象 |
猜想 不成立 |
|
步骤二:取少量滤液于试管中,加入适量稀硫酸 |
有白色沉淀生成 |
猜想三成立 |
【反思拓展】
Ⅰ.探究反应后溶液中溶质的成分,既要考虑生成物,又要考虑反应物是否有剩余。
Ⅱ.依据复分解反应发生的条件,步骤二中除可用稀硫酸外,还可选用 (填字母序号)也能达到同样的实验目的。
a.稀盐酸
b.氢氧化钠溶液
c.碳酸钠溶液
(8分) 研究小组设计分离NaCl和CaCl2混合物样品方案如下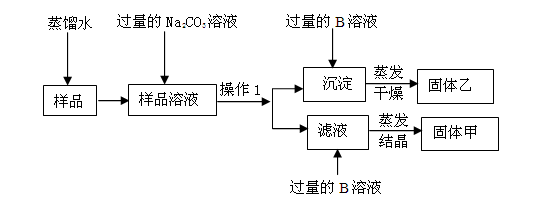
回答下列问题:固体甲是。固体乙是。
“操作1”是。
Na2CO3溶液与样品溶液发生反应的化学方程式是 。
用离子符号表示滤液中含有的离子。
过量的B溶液与沉淀发生反应的化学方程式是 。
(14分)小涵是一个勤于思考、喜欢钻研的同学,下课后他对课上老师演示硫酸除去铁锈的实验产生了疑问,并提出问题和同学们一起探究:
【提出问题】硫酸中哪一种粒子(H2O、H+、SO42-)能除去铁锈?
【提出猜想】
猜想1能除去铁锈的粒子是H2O
猜想2能除去铁锈的粒子是
猜想3能除去铁锈的粒子是
【设计实验】
| 实 验 步 骤 |
现象 |
结论 |
| (1)取一支试管,放入生锈的铁钉,并加入2ml蒸馏水,振荡 |
铁锈没有消失 |
说明不能除去铁锈 |
| (2)取一支试管,放入生锈的铁钉,并加入2ml Na2SO4溶液,振荡 |
说明SO42-不能除去铁锈 |
|
| (1)取一支试管,放入生锈的铁钉,并加入2ml稀硫酸,振荡 |
铁锈消失 |
你得出的结论是 |
【反思与评价】韬韬同学很快写出了硫酸除铁锈的化学方程式,韬韬经过思考后认为第(1)步没有必要进行,他的理由是。
在师生联谊晚会上,化学老师表演了“吹气生火”的魔术。用棉花将一种淡黄色的固体包裹其中,将一根长玻璃管插入棉花团中吹气,稍后棉花团剧烈燃烧起来。同学们为了揭开这个魔术的秘密,进行了如下探究。
【相关信息】①淡黄色固体成分是过氧化钠(Na2O2)。
②吹出的气体主要成分有氮气、二氧化碳和水蒸气。
③过氧化钠与氮气不反应。
【分析讨论】根据棉花团剧烈燃烧的现象分析,反应中除了生成氧气外,还说明过氧化钠发生的反应是(填“吸热”或“放热”)反应。
【提出猜想】同学们发现残留固体呈白色,对该固体成分进行猜想:
猜想Ⅰ:固体成分是Na2CO3, CO2参加反应。
猜想Ⅱ:固体成分是NaOH, H2O参加反应。
猜想Ⅲ:固体成分是,CO2和H2O均参加反应。
【实验探究】同学们在老师带领下用足量且潮湿的CO2气体通入过氧化钠粉末中,充分反应后,取白色固体于试管中配成溶液,设计实验对猜想进行验证。
验证Ⅰ:向溶液中滴加稀盐酸,发现有气泡产生。有同学认为固体成分仅含有Na2CO3。
验证Ⅱ:蘸取少量溶液滴到pH试纸上,与标准比色卡比较,pH大于7,有同学认为固体是NaOH。请问此结论是否正确?(填“正确”或“错误”),原因是:。
验证Ⅲ:先向溶液中加入足量的溶液,看到白色沉淀产生,写出反应方程式;然后向上层清液中加入溶液,看到溶液呈红色,验证了猜想Ⅲ是正确的。
【实验反思】由验证Ⅲ的结果可知,验证Ⅰ的结论错误,因为它不能排除的存在。
【拓展延伸】根据探究所获得的知识,有同学认为可以用过氧化钠做“滴水生火”的魔术,从燃烧的要素考虑,你认为要使魔术成功必须控制 的用量。
某校“我与化学”活动小组在探究活动中要制取一定量的氨气。该小组查阅资料可知:
①常温下NH3是一种无色、有刺激性气味的气体,极易溶于水,密度比空气小。
②氯化铵固体和熟石灰粉末在加热条件下生成氨气
2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O
CaCl2 + 2NH3↑+ 2H2O根据以上信息和如下图所示装置,完成下列空白:

制取氨气发生装置是 (填序号),制取氨气收集装置是 (填序号)。NH3水溶液呈碱性,能使湿润的紫色的石蕊试纸变成蓝色。收集氨气时,检验氨气集满的方法是(写出实验操作及现象) 。
NH3具有还原性,加热条件下能够还原氧化铜得到单质铜。判断反应发生的现象是 。
B装置可用于实验室制取氧气,其化学方程式是 。
某同学根据日常经验推测,可燃物燃烧可能与氧气和温度有关,设计并完成下列实验进行验证:
白磷燃烧的化学方程式为。
图①中铜片上的白磷燃烧而水中的白磷不燃烧,证明了可燃物燃烧必须要。通过“图①中的白磷和图②中水中的白磷通入氧气后燃烧”的实验现象比较,能得出同样结论的。
图①中,铜片上的白磷燃烧而红磷不燃烧,证明了红磷的着火点比白磷的,同时也证明了可燃物燃烧还需要。
实验室中白磷保存在水中,破坏燃烧的条件是。
A.清除可燃物B.隔绝跟空气接触 C.使温度降到着火点以下