某小组开展“木耳中铁元素的检测”活动。检测方案的主要步骤有:粉碎、称量、灰化、氧化、稀释、过滤、滴定等。回答问题:
(1)实验方案中出现的图标 和
和 ,前者提示实验中会用到温度较高的设备,后者要求实验者_____(填防护措施)。
,前者提示实验中会用到温度较高的设备,后者要求实验者_____(填防护措施)。
(2)灰化:干燥样品应装入_____中(填标号),置高温炉内,控制炉温 ,在充足空气氛中燃烧成灰渣。
| A. |
不锈钢培养皿 |
| B. |
玻璃烧杯 |
| C. |
石英坩埚 |
(3)向灰渣中滴加 的硝酸,直至没有气泡产生。灰化容器中出现的红棕色气体主要成分是_____(填化学式),因而本实验应在实验室的_____中进行(填设施名称)。

若将漏斗直接置于容量瓶上过滤收集滤液(如图所示),存在安全风险,原因是__________。
(4)测定铁含量基本流程:将滤液在 容量瓶中定容,移取 ,驱尽 并将 全部还原为 。用 微量滴定管盛装 标准溶液进行滴定。
①选用微量滴定管的原因是__________。
②三次平行测定的数据如表。针对该滴定数据,应采取的措施是_____。
|
序号 |
1 |
2 |
3 |
|
标准溶液用量/ |
|
|
|
③本实验中,使测定结果偏小的是_____(填标号)。
| A. |
样品未完全干燥 |
| B. |
微量滴定管未用标准溶液润洗 |
| C. |
灰渣中有少量炭黑 |
(14分)欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数。资料表明:①反应中除生成NO2气体外还有少量的NO生成;②常温下N02与N2O4混合存在,在低于0℃时几乎只有无色N2O4液体或晶体存在。为完成测定并验证有NO生成,有人设计下图实验装置。
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是________________________________________________。
(2)装置B瓶的作用是___________________________________________。
(3)A中反应停止后,打开D中的活塞K2并通人氧气,若反应中确有NO产生,则D中应出现的现象是________________;实验发现,通人氧气温度的高低对实验现象有较大影响,则为了便于观察应通人_______________(填“冷”或“热”)的氧气。
(4)为了减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是: ___________________________________________________。
(5)实验测得下列数据:所用铜银合金质量为15.0 g,浓硝酸的体积为40 mL,浓度为13.5mol·L-1。实验后:A中溶液体积为40mL,H+浓度为1.0mol·L-1。若设反应中硝酸既无挥发也无分解,则:
①参加反应的硝酸的物质的量为______________;
②若已测出反应后E装置的生成物含氮元素的质量,则为确定合金中铜的质量分数,还需要测定的数据是__________。
(6)实验中只测定铜的质量分数,不验证NO的产生,则在铜银合金与硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程_______________ ____。
某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象如下表。请你帮助该同学整理并完成实验报告:
| 实验方案 |
实验现象 |
| ①用砂纸擦后的镁带与沸水反应,再向反应后溶液中滴加酚酞 |
(A)浮于水面,熔成小球,在水面上游动,随之消失,溶液变红 |
| ②向新制的H2S饱和溶液中滴加新制的氯水 |
(B)产生气体,可在空气中燃烧,溶液变为浅红色 |
| ③钠与滴有酚酞试液的冷水反应 |
(C)反应不十分强烈,产生的气体可在空气中燃烧 |
| ④镁带与2mol/L盐酸反应 |
(D)剧烈反应,产生可燃气体 |
| ⑤铝条与2mol/L盐酸反应 |
(E)生成白色胶状沉淀,后来沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 |
(F)生成淡黄色沉淀 |
(1)实验目的:研究同周期元素性质递变规律
(2)实验用品:
仪器: ①________②________③________④试管夹⑤镊子⑥小刀⑦玻璃片⑧砂纸等;
药品:钠、镁带、铝条、2mol/L的盐酸、新制的氯水、饱和的H2S溶液、AlCl3溶液、NaOH溶液等。
(3)实验内容:(填写与实验方案相对应的实验现象)
①______②______③______④______⑤______⑥______(用A-F表示)
(4)实验结论:
金属性: ________________非金属性: ________________
(5)写出⑥的离子方程式:_________________________________。
某研究性学习小组为证明2Fe3+ + 2I-  2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
2Fe2+ + I2为可逆反应(即反应存在一定的限度),设计如下几种方案。已知FeF63-是一种无色的稳定的络离子。
按要求回答下列问题。
方案甲:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,再继续加入2mL CCl4,充分振荡。静置、分层,再取上层清液,滴加KSCN溶液。
(1)甲方案中能证明该反应为可逆反应的现象是。
(2)有同学认为该方案设计不够严密,即使该反应为不可逆反应也可能出现上述现象,其原因是。
方案乙:
取5mL 0.1mol/L KI溶液,滴加2ml 0.1mol/L 的FeCl3溶液,溶液呈棕黄色,再往溶液中滴加NH4F溶液,若看到现象,即可证明该反应为可逆反应,请解释产生该现象的原因。
方案丙:
设计如图原电池装置,接通灵敏电流计,指针向右偏转(注:灵敏电流计指针总是偏向电源正极),随着时间进行电流计读数逐渐变小,最后读数变为零。
当指针读数变零后,在乙烧杯中加入1mol/L FeCl2溶液,若观察到灵敏电流计的指针向方向偏转(填“左”、“右”或“不移动”),即可判断该反应为可逆反应,此时甲中石墨电极上的电极反应式为。
实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 |
A |
B |
C |
| 10% H2O2/mL |
20.0 |
V1 |
V2 |
| 2mol/L FeCl3/ mL |
0 |
5.0 |
10.0 |
| H2O/ mL |
V3 |
V4 |
0 |
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测推(计)算反应速率。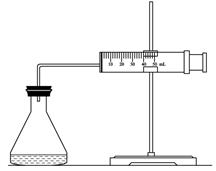
(2)为实现实验目的,则V1=,V2=;
V3=,V4=。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是(填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
。
某研究性学习小组设计不同实验方案来研究硝酸的性质。
(1)甲组同学设计下图装置来证实稀硝酸与铜反应,步骤如下。
A、检验50ml针筒的气密性。
B、抽出活栓,往针筒内放入一小块铜片,把针筒活栓推到底,将针筒下端玻璃管浸入蒸馏水中,抽拉活栓,吸入约10mL蒸馏水,发现针筒内仍有空气,然后。
C、将针筒下端玻璃管浸入浓硝酸中,抽拉活栓,缓缓吸入4mL浓硝酸,将针筒下端套上橡皮管,然后用铁夹夹住。
回答以下相关问题:
①B中应补充的操作是。
②一段时间后在针筒内观察到溶液颜色为蓝色,有色气体产生。该反应的离子方程式为。
③反应停止后,针筒内产生了气体,要验证产生的气体是NO,还需进一步进行的操作是。
(2)乙组同学也用此装置直接抽取浓硝酸和铜反应,发现溶液是绿色的,为了探究绿色的原因,乙组同学又做了三组对比实验,具体如下:
| 组 |
m(Cu)/g |
硝酸(过量) |
溶液颜色 |
| A |
1 |
浓HNO3(4mL) |
溶液为绿色 |
| 1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
| B |
0.5 |
浓HNO3(4mL) |
溶液为绿色 |
| 1 |
稀HNO3(4mL) |
溶液为蓝色 |
|
| C |
2 |
浓HNO3(4mL) |
溶液为绿色 |
| 1 |
稀HNO3(4mL) |
溶液为蓝色 |
根据乙组同学三组对比实验回答问题:
①一种观点认为:这可能是Cu2+浓度差异的结果,你同意这种看法吗?(填“同意”或“不同意”)__________,原因是。(结合表格信息加以阐述)
②另一种观点认为:溶液呈绿色是铜与浓硝酸反应时产生的NO2溶于过量浓硝酸显黄色,加上和蓝色的硝酸铜溶液混在一起,使溶液呈绿色。为了验证推断是否正确,三位同学分别设计了三种方案,并进行验证:
方案一:将绿色溶液转移至试管,并给试管加热片刻,立即看到大量红棕色气体产生。认为该气体一定是溶解在溶液中的NO2,但也有同学持有异议。请分析原因。
方案二:用双氧水和二氧化锰制得氧气,并把氧气缓缓通入绿色溶液中,观察溶液颜色变为蓝色。请用方程式表示溶液颜色变化的反应原理______________________。
方案三:往蓝色溶液中缓缓通入NO2气体,溶液颜色变绿色。
③从环保的角度看,你认为三个方案中最好的是哪一个。