X、Y、Z三种化合物均由短周期元素组成。已知三种化合物的水溶液的焰色反应均呈黄色,Y和Z均由三种元素组成。请根据题目的要求回答下列问题。
(1)固体化合物X为浅黄色粉末,该化合物中含有化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键
(2)写出X与二氧化碳反应的化学方程式 。
(3)下表为Y和Z实验的部分内容
| 序号 |
主要实验步骤及实验现象 |
| ① |
在Y的无色溶液中,加入稀硫酸,放置。产生浅黄色沉淀和无色有刺激性气味的气体。该气体可使品红溶液褪色。 |
| ② |
在Z的无色溶液中,滴加的盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀。 |
| ③ |
将实验②最终得到的混合物加热蒸发、灼烧,最终得到固体。 |
写出含0.1 mol Z的溶液与20 mL 5mol/L的盐酸反应的离子方程式:
实验③加热蒸发、灼烧得到的最终产物主要是 和 。
(4)写出Y与稀硫酸反应的离子方程式 。
图中A-J均为有机化合物,根据图中的信息,回答下列问题: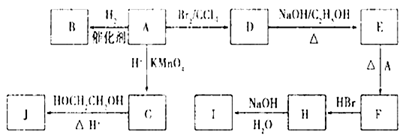
(1)环状化合物A的相对分子质量为82,其中含碳87. 80%,含氢12. 20%。B的一氯代物仅有一种,B的结构简式为;
(2)M是B的一种同分异构体,M能使溴的四氯化碳溶液褪色,分子中所有的碳原子共平面,则M的结构简式为;
(3)由A生成D的反应类型是___________,由D生成E的反应类型是___________;
(4)(3分)G的分子式为C6H10O4,0.146 g G需用20 mL0.100 mol/L NaOH溶液完全中和,J是一种高分子化合物。则由G转化为J的化学方程式为:
(5)H中含有的官能团是(名称)________,I中含有的官能团是(名称)___________。
按下图所示装置进行实验,并回答下列问题:
(1)锌极为________极,电极反应式为;
铜极为________极,电极反应式为;
(2)石墨棒C1为________极,电极反应式为;
石墨棒C2附近发生的实验现象为。
(3)当C2极析出224 mL气体(标准状况)时,锌的质量(填“增加”或“减少”)g ;
CuSO4溶液的质量(填“增加”或“减少”)g。
无色透明溶液中可能含有下列离子:K+、Al3+、Fe3+、Ba2+、NO3-、SO42-、HCO3-、Cl-,取该溶液进行如下实验:①用蓝色石蕊试纸检测该溶液,试纸显红色;
②取原溶液少许,加铜片和稀硫酸共热,产生无色气体,该气体遇空气立即变为红棕色;
③取原溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取原溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。请回答下列问题:
(1)根据上述实验判断原溶液中上述离子肯定存在的是,
肯定不存在的是。
(2)写出与②③两个实验有关的离子方程式:
②,
③。
(5分)某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)(2分)硫酸铜溶液可以加快氢气生成速率的原因。
(2)(1分)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是。
(3)(2分)要加快上述实验中气体产生的速率,还可采取的措施有(答两种):;。
(10分)臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是和(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如表所示。已知:O3的起始浓度为 0.021 6 mol/L。
①pH增大能加速O3分解,表明对O3分解起催化作用的是。
②在30℃、pH=4.0条件下,O3的分解速率为。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为(填字母代号)。
A.40 ℃、pH=3.0B.10 ℃、pH=4.0C.30 ℃、pH=7.0