通常情况下,微粒和为分子,和为阳离子,为阴离子,它们都含有10个电子;溶于后所得的物质可电离出和;、、三种微粒反应后可得和一种白色沉淀。请回答:






(1)用化学符号表示下列4种微粒:: :: :。
(2)写出、、三种微粒反应的离子方程式:、。
现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式_________________________________________。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为:___________________________________________。
(3)某原电池中,电解质溶液为稀H2SO4,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应:________________________;
负极反应:________________________;
电解质溶液pH的变化_______.(填“增大”“减小”或“不变”.下同)
(14分)A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素。在一定条件下相互转化关系如图所示(部分产物已略去)。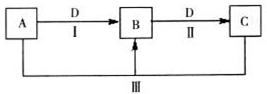
请按要求回答下列问题:
(1)若B、D为短周期同一主族的非金属单质,则反应(III)中氧化产物与还原产物的物质的量之比为___。
(2)若A、B、C均为短周期元素组成的化合物,且溶液都显碱性,D为植物光合作用必须吸收的气体,物质A中化学键的类型为________________,相同温度下的溶解度B___________C(填“大于、小于、等于”)。
(3)若D为某金属单质,向C的溶液中滴加硝酸银溶液,产生不溶于稀硝酸的白色沉淀,则检验B溶液中阳离子的试剂为_________;C的溶液保存时,常加入D的目的是__________________。
(4)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,写出反应(III)的离子方程式是_______________________________;符合条件的D物质可能是_______________(填序号)。
①硫酸 ②碳酸 ③氢氧化钠 ④一水合氨 ⑤氯化钡
【原创】C、N、O、Na、Al、Si、Cl、Fe是常见的元素
(1)Fe元素位于元素周期表的位置 ;二氧化碳的结构式为 。
(2)以上某种元素的氢化物和该元素的最高价含氧酸反应可以生成盐,请写出实验室制备该元素氢化物的化学方程式:____________________________________________。
(3)碳和硅的最高价氧化物对应水合物的酸性强弱顺序为:__________________。
(4)以上主族元素中金属性最强的是__________。单质能用于芯片的是____________。(写元素符号)
(5)氧化铝和氢氧化钠反应的离子方程式为:________________________。
(8分)如图所示,是原电池的装置图( 为电流表)。请回答:
为电流表)。请回答: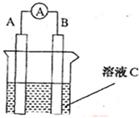
(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为 ;反应进行一段时间后溶液C的pH将 (填“升高”“降低”或“基本不变”)。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如上图所示的原电池装置,则A(负极)极材料为 ,B(正极)极材料为 ,溶液C为 。
(3)若C为NaOH溶液,A电极材料为Al,B电极材料为Mg,负极上发生的电极反式为 。
【原创】某小组的同学想利用原电池的反应检测金属的活动性顺序,使用镁片和铝片,可选用的溶液有2mol/L的硫酸,2mol/L的氢氧化钠,和10.0 mol/L的浓硝酸。甲、乙、丙三名同学分别设计如下装置。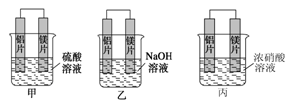
(1)甲中_____________做负极,正极的电极反应式为________________。
(2)乙中__________做负极,丙中______做正极。乙中总反应的离子方程式为________。
(3)如果甲和乙同学都认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出______活动性更强,而乙会判断出_______活动性更强。(填元素符号)。
(4)由此实验,可得到如下哪些正确的结论()
| A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质 |
| B.该实验说明金属活动性顺序表已经过时,没有使用价值 |
| C.镁的金属性不一定比铝强 |
| D.实验说明化学研究需要具体问题具体分析 |