A、B、C是元素周期表中前18号元素中的3种单质,甲、乙是常见的化合物,它们之间存在如右图所示关系。
(1)右图反应①~③中属于化合反应的是_____(填序号)。
(2)若甲常温下呈液态,A常温下是固态非金属单质,则乙的化学式是_____________;
若甲常温下呈液态,A常温下是气态非金属单质,则乙的电子式是_____________;
(3)若甲常温下呈气态,A是常见的金属单质,写出A和甲在一定条件下反应的化学方程式____________________________ _______;
(4)若A、B属于同一主族的高硬度单质,则A、甲反应在工业上的用途是__________。
(12分)本题包括A、B两小题,请选定其中一题作答。若多做,则按A小题评分。
A.【物质结构与性质】
K2Cr2O7是一种常见的强氧化剂,酸性条件下会被还原剂还原成Cr3+。
(1)Cr3+能与OH-、CN-形成配合物[Cr(OH)4]-、[Cr(CN)6]3-。
①Cr3+的电子排布式可表示为________。
②不考虑空间构型,[Cr(OH)4]-的结构可用示意图表示为________。(若有配位键,用箭号表示)
③CN-与N2互为等电子体,写出CN-的电子式:________。
(2)K2Cr2O7能将乙醇氧化为乙醛,直至乙酸。
①乙醛中碳原子的杂化方式有________、________。
②乙酸的沸点是117.9 ℃,甲酸甲酯的沸点是31.5 ℃,乙酸的沸点高于甲酸甲酯的沸点的主要原因是____。
(3)一种新型阳极材料LaCrO3的晶胞如图所示,已知距离每个Cr原子最近的原子有6个,则图中________原子代表的是Cr原子。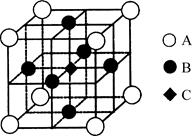
(14分)还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)===2NO(g);ΔH=+180.6 kJ·mol-1
C(s)+O2(g)===CO2(g);ΔH=-393.5 kJ·mol-1
反应C(s)+2NO(g)===CO2(g)+N2(g);ΔH=________kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如图所示,OH与NO2的反应为NO2+OH===HNO3。写出OH与NO反应的化学方程式:___________。
(3)下图所示的装置能吸收和转化NO2、NO和SO2。
①阳极区的电极反应式为____。
②阴极排出的溶液中含S2O42-离子,能吸收NOx气体,生成的SO32-可在阴极区再生。将S2O42-吸收NO2的离子方程式配平,并在方格内填上相应物质:____S2O42-+____NO2+____OH-===SO32-+____N2+____
③已知阴极生成的吸收液每吸收标准状况下7.84 L的气体,阳极区新生成质量分数为49%的硫酸100 g,则被吸收气体中NO2和NO的物质的量之比为________。
(4)O3、醛类、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:________。
(12分)次硫酸氢钠甲醛(xNaHSO2·yHCHO·zH2O)俗称吊白块,在印染、医药以及原子能工业中有广泛应用。它的组成可通过下列实验测定:① 准确称取1.540 0 g样品,完全溶于水配成100 mL溶液;② 取25.00 mL所配溶液经AHMT分光光度法测得甲醛物质的量浓度为0.10 mol·L-1;③ 另取25.00 mL所配溶液,加入过量碘完全反应后,加入BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重得到白色固体0.582 5 g。次硫酸氢钠甲醛和碘反应的方程式如下:
xNaHSO2·yHCHO·zH2O+I2―→NaHSO4+HI+HCHO+H2O(未配平)
(1)生成0.582 5 g白色固体时,需要消耗碘的质量为________。
(2)若向吊白块溶液中加入氢氧化钠,甲醛会发生自身氧化还原反应,生成两种含氧有机物,写出该反应的离子方程式________________________________。
(3)通过计算确定次硫酸氢钠甲醛的组成(写出计算过程)。
【化学——选修3:物质结构与性质】磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。回答下列问题:
(1)上述反应物中的一种元素,其基态原子具有八种不同能量的电子,写出其基态原子的价电子排布式。
(2)BP中每个B或P原子均形成几个共价键,其中有一个配位键,其中提供孤电子对的是原子。
(3)磷化硼的晶体类型是,B原子的杂化方式是,每生成1molBP,共形成molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:PB(填“>”、“<”)
(5)BBr3分子中,键角为,为(填“极性”或“非极性”)分子。
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是。
【化学——选修2:化学与技术】水处理技术在生产、生活中应用广泛,对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)水的净化和软化的区别是________。
(2)①生活用水必须保证安全,自来水厂需要对取自江河湖泊中的淡水进行杀菌消毒、混凝沉淀、过滤等工艺处理,这三项处理的正确顺序是_________。
②下列试剂能够用来对自来水进行杀菌消毒,且不会造成二次污染的是_______填字母)。
a.福尔马杯b.漂白粉c.氯气d.臭氧
(3)Na2FeO4是一种新型水处理剂,工业上可用FeSO4制备Na2FeO4其工艺流程如下:
①工业上常用硫酸亚铁作混凝剂除去天然水中含有的悬浮物和胶体,为了达到更好的效果,要将待处理水的pH调到9左右,再加人绿矾。请解释这一做法的原因:________________________。用必要的离子方程式和文字描述)。
②写出由Fe(OH)3制取Na2FeO4的化学方程式:____________。
(4)石灰纯碱法是常用的硬水软化方法,已知25℃时KSP(CaCO3)=2.8×10-9,现将等体积的Ca(OH)2溶液与Na2CO3溶液混合(假设溶液体积具有加和性),若Na2CO3溶液的浓度为5.6×10-5mol·L‑1,则生成沉淀所需Ca(OH)2溶液的最小浓度为____________。