用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是( )
| A.将FeCl3溶液滴入蒸馏水中即可 |
| B.将FeCl3溶液滴入热水中,得到黄色液体即可 |
| C.将FeCl3溶液滴入沸水中,得到红褐色溶液即可 |
| D.将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可 |
印刷铜制电路板的“腐蚀液”为FeCl3溶液已知铜、铁均能与FeCl3溶液反应,反应方程式分别为:Cu+2FeCl3=2FeCl2+CuCl2,Fe+2FeCl3=3FeCl2。现将一包铜、铁的混合粉末加入到盛有FeCl3溶液的烧杯中,充分反应后烧杯中仍有少量固体。关于烧杯中物质组成的说法正确的是
| A.溶液中一定含FeCl3,固体一定是铁和铜 |
| B.溶液中一定含FeCl2,固体一定含铜 |
| C.溶液中一定含FeCl2、CuCl2,固体一定含铜 |
| D.溶液中一定含FeCl2,固体一定是铁和铜 |
在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如图所示,则原来混合溶液中Al2(SO4)3和MgSO4的物质的量浓度之比为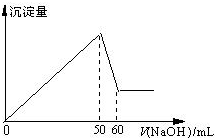
| A.6:1 | B.3:1 | C.2:1 | D.1:2 |
某温度下将Cl2通入KOH溶液里,反应后得到KCI、KC1O、KC1O3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则C12与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
| A.1:3 | B.4:3 | C.2:1 | D.3:l |
在配制一定物质的量浓度的NaOH溶液时,下列哪个原因会造成所配溶液浓度偏高
| A.所用NaOH已经潮解 | B.定容时俯视 |
| C.未洗涤烧杯及玻璃棒 | D.称量时误用“左码右物” |
能将分别含有Cu2+、Fe3+、Al3+、Mg2+、Fe2+、NH4+、Na+等离子的七种溶液一次性鉴别开来的试剂是
| A.NaHCO3溶液 | B.NaOH 溶液 | C.KSCN 溶液 | D.NH3·H2O |