最近,德国科学家实现了铷原子气体超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。已知铷是37号元素,质量数是85。根据材料完成下列问题:
(1)铷Rb37位于周期表的第______________周期、第________________族。
(2)关于铷的结构和性质判断正确的是( )
①与水反应比钠强烈 ②它的原子半径比钠小③它的氧化物暴露在空气中易吸收CO2
④它的阳离子最外层电子数和镁相同 ⑤它是还原剂
A.①③④ B.②③⑤ C.②④ D.①③⑤
(3)氢化铷与水反应可放出氢气,则下列叙述正确的是( )
A.氢化铷溶于水显酸性
B.氢化铷中氢离子被还原为氢气
C.氢化铷与水反应时,水是还原剂
D.氢化铷中氢离子最外层有两个电子
(4)现有铷和另一种碱金属形成的合金50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,这种碱金属可能是( )
A.Li B.Na C.K D.Cs
【化学——选修有机化学基础】
下图中 A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
根据上图回答问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为。
(2)化合物B不能发生的反应是(填字母序号):
a.加成反应 b.取代反应 c.消去反应 d.酯化反应 e.水解反应 f.置换反应
(3)反应②的化学方程式是。
(4)C分子中的官能团名称是;A的结构简式是。
(5)同时符合下列三个条件的B的同分异构体的数目有个。
Ⅰ.含有间二取代苯环结构Ⅱ.属于非芳香酸酯Ⅲ.与 FeCl3溶液发生显色反应。写出其中任意一个同分异构体的结构简式。
【化学-物质结构与性质】
N和B元素在化学中有很重要的地位。
(1)写出与N元素同主族的As元素的基态原子核外电子排布式_________________。
从原子结构的角度分析B、N和O元素的第一电离能由大到小的顺序为___________。
(2)N元素与B元素的氟化物化学式相似,均为AB3型,但分子的空间结构有很大不同,其原因是_____________________________________________,其中BF3的分子构型为__________。
(3)立方氮化硼可利用人工方法在高温高压条件下合成,其硬度仅次于金刚石而远远高于其它材料,因此它与金刚石统称为超硬材料。BN的晶体结构与金刚石相似,其中B原子的杂化方式为________,微粒间存在的作用力是________。
(4)NaN3是抗禽流感药物“达菲”合成过程中的中间活性物质,NaN 3也可用于汽
车的保护气囊。3 mol NaN 3受撞击会生成4 mol N2气体和一种离子化合物A。
①请写出上述NaN 3撞击反应的化学方程式。
②根据电子云的重叠方式判断:N2分子中存在的σ键和π键数目之比为:。
某短周期元素原子最外层电子数为次外层的2倍,其单质甲可发生:
甲+乙 丙+丁+水。
丙+丁+水。
(1)若丙为NO2。①甲与乙反应的化学方程式为。
② NO2可作火箭重要燃料—肼(N2H4)的助燃剂。N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ·mol-1,2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) △H=—1135.7 kJ·mol-1,写出肼(N2H4)燃烧生成氮气和水蒸气的热化学方程式:。
(2)若丙为SO2。①把乙滴入硫酸铜晶体,观察到的现象是。
②完成SO2使KMnO4褪色的离子方程式:MnO4- +SO2 +=Mn2+
+SO42- +H+
③一定条件下:2SO2(g)+O2(g)  2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是
2SO3(g) △H<0。反应的平衡常数表达式K=;反应达平衡时,若改变其中一个条件x,则符合图中曲线的是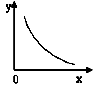
a.x表示温度,y表示n(SO2) b.x表示压强,y表示SO2的转化率
c.x表示n(SO2),y表示n(O2) d.x表示n(SO3),y表示化学平衡常数K
(13分)硫代硫酸钠是一种常见的化工原料。将SO2通入按一定比例配成的Na2S和Na2CO3的混合溶液中,便可得到Na2S2O3,其制备反应方程式为: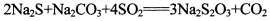 o
o
(1)在配制混合溶液前先将蒸馏水加热煮沸一段时间后待用,其目的是_______。
(2)用该方法获得的Naj2O3^H2O晶体中常混有一定量的杂质。某兴趣小组欲对其中所含杂质成分进行探究(不考虑副反应和杂质所带的结晶水)。
【提出假设】
假设1 :晶体中只含>fe2C03杂质
假设2:晶体中只含Na2S杂质
假设3: ____________________________
【查阅资料】
②NhS2O3在中性、碱性溶液中较稳定,而在酸性溶液中能迅速反应: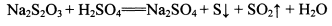
【判断与思考】
某同学取少量制得的晶体溶于足量稀H2SO4,并将产生的气体通入CuSO4溶液中,未见黑色沉淀,据此认为假设2不成立。你认为其结论是否合理?_______ (填“合理”、“不合理”)并说明理由:____________________________
【设计方案进行实验】
基于假设1,完成下表实验方案、现象及结论(仪器自选)。
限选实验试剂: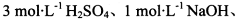 酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
酸性KMnO4溶液、饱和NaHCO3溶液、品红溶液、澄清石灰水
(3)已知: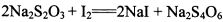 。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用
。为测定所制得晶体的纯度,该小组以淀粉作指示剂,用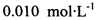 的碘水进行多次取样滴定,测得
的碘水进行多次取样滴定,测得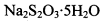 的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
的含量约为102%。若所用试剂及操作均无不当,产生该结果最可能的原因是______________。
(14分)在氯化银的表面负载银纳米颗粒后将具有优秀的光催化性能,可用于光催化降解污水中的有机污染物。某课题组利用如下流程制备这种光催化剂,并同时获取新型净水剂高铁酸钠。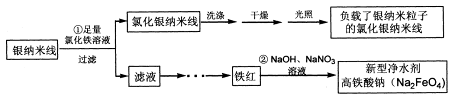
(1)写出①反应的离子方程式______________
(2) 过滤得到氯化银纳米线须洗涤干净后再进行光照。检验氯化银纳米线是否洗净的操作方法是____________________________
(3) 反应②的离子方程式是
(4) 由21.60g银纳米线得到了25.15g最终产物,则产物中银纳米粒子的质量分数是_______。(计算结果保留两位小数)