如右图所示,常温下电解5 min后,铜电极质量增加2.16g。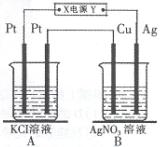
试回答:
(1)电源电极X名称为 (填“正极”或“负极”),B中 铜电极的名称 。
(2)电解池B中阳极的电极反应式是 。
(3)若A中KCl溶液的体积是200mL,电解后溶液的
PH= (忽略电解前后溶液体积的变化)。
若要使电解后的溶液恢复到与电解前完全相同,应
加入 。
(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵: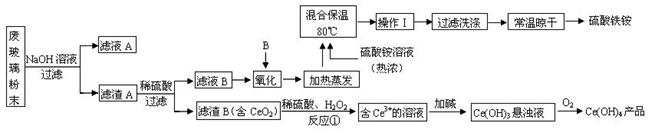
已知:
ⅰ.酸性条件下,铈在水溶液中有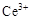 、
、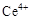 两种主要存在形式,
两种主要存在形式,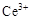 易水解,
易水解,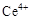 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。
滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
(16分)实验室中以粗铜(含杂质)为原料,某种制备铜的氯化物的流程如下: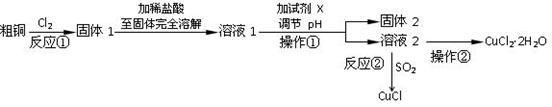
按要求回答下列问题:
(1)操作①的所用到的玻璃仪器有______________。
(2)上述流程中,所得固体1需要加稀盐酸溶解,其理由是;
溶液1可加试剂X用于调节pH以除去杂质,X可选用下列试剂中的(填序号)___________。
A.NaOHB.NH3·H2OC.CuOD.CuSO4
(3)反应②是向溶液2中通入一定量的SO2,加热一段时间后生成CuCl白色沉淀。写出
制备CuCl的离子方程式:。
(4)现用如图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜反应(铁架台、铁夹省略)。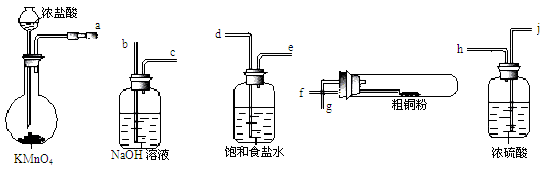
①按气流方向连接各仪器接口顺序是:a→、 → 、 → 、 → 。实验中大试管加热前要进行一步重要操作,其操作是。
②反应时,盛粗铜粉的试管中的现象是。
(5)在溶液2转化为CuCl2·2H2O的操作过程中,发现溶液颜色由蓝色变为绿色。小组同学欲探究其原因。已知:氯化铜溶液中有如下转化关系:
Cu(H2O)42+(aq) + 4Cl-(aq) CuCl42-(aq) + 4 H2O (l)
CuCl42-(aq) + 4 H2O (l)
蓝色绿色
该同学取氯化铜晶体配成蓝绿色溶液Y,进行如下实验,其中能证明溶液中有上述转化关系的是(填序号)。
A.将Y稀释,发现溶液呈蓝色B.在Y中加入CuCl2晶体,溶液变为绿色
C.在Y中加入NaCl固体,溶液变为绿色D.取Y进行电解,溶液颜色最终消失
(1)NO2有较强的氧化性,能将SO2氧化生成SO3,本身被还原为NO,已知下列两反应过程中能量变化如图所示: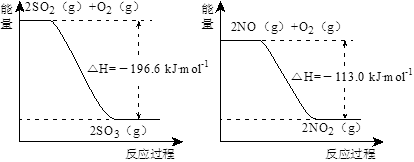
则NO2氧化SO2的热化学方程式为_________________________________。
(2)在2L密闭容器中放入1mol氨气,在一定温度进行如下反应:2NH3(g)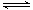 N2(g)+3H2(g),
N2(g)+3H2(g),
反应时间(t)与容器内气体总压强(p)的数据见下表
| 时间t/min |
0 |
1 |
2 |
3 |
4 |
5 |
| 总压强p 100 kPa |
5 |
5.6 |
6.4 |
6.8 |
7 |
7 |
则平衡时氨气的转化率为___________。
(3)25℃,某二元弱酸H2A与NaOH溶液反应可生成NaHA、Na2A,溶液中含A各微粒的分布分数(平衡时某含A微粒的浓度占各含A微粒浓度之和的分数)随溶液变化的情况如下图所示: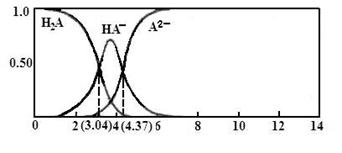
已知:103.04=1.1×103,104.37=2.3×10425℃,Ka1(H2CO3)= 4.4×10-7 Ka2(H2CO3) = 4.7×10-11
①若向0.1NaHAmol·L-1溶液中加入少量NaOH溶液,c(A2-)/c(HA-)的值(填“增大”、“减小”或“不变”,下同),c(H+)/c(OH-) 的值。
②若向0.1NaHAmol·L-1溶液中加入氨水至溶液呈中性,则c(H2A)+c(NH4+)c(A2-) (填“大于”、“小于”或“等于”)。
③计算HA-二级电离平衡常数Ka2=。
④将过量H2A加入Na2CO3溶液中反应的离子方程式为:。
【化学—选修5:有机化学基础】
苯的同系物是人类最早认识的芳香族化合物,其中对二甲苯(英文名称p—xylene,缩写为PX)是化学工业的重要原料。
(1)写出PX的结构简式______________。
(2)PX可能发生的反应有_______、________。(填反应类型,只填两种。)
(3)有机物M存在如下图所示的转化关系,其中A 是PX的一种同分异构体。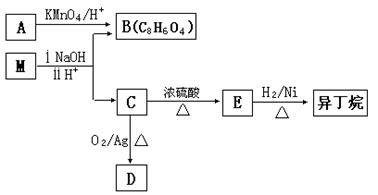
已知:M的分子式为C16H22O4,D能发生银镜反应。
①B的苯环上存在3 种不同化学环境的氢原子,则B 的结构简式是__________。
②D分子中所含的官能团是______________(填化学式)。
③M的结构简式是_______________。
(4)F是B 的一种同分异构体,具有如下特征:
a.是苯的对位二取代物;b.遇FeCl3溶液显示紫色;c.能与碳酸氢钠溶液反应。
写出F与NaHCO3溶液反应的化学方程式_____________________________。
【化学—选修3:物质结构和性质】
元素周期表是研究元素原子结构及性质的重要工具。现有X、Y和Z三种元素,其原子序数依次减小。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素既可以形成正一价离子也可形成负一价离子。请回答下列问题:
(1)Y元素原子的价层电子的轨道表示式为______________,该元素的名称是_____;
(2)在X与Z形成的化合物XZ3中,X的杂化类型是,该化合物的空间构型为_____________;短周期元素形成的化合物中与XZ3互为等电子体的是 ;
(3)请写出X的两种含氧酸的化学式、,其中酸性较强的是。
(4)Q与Z同主族。Q单质的晶胞如下图所示,若设该晶胞的密度为ag/cm3,阿伏加德罗常数为NA,Q原子的摩尔质量为M,则表示Q原子半径的计算式为 。