[化学—选修物质结构与性质]
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。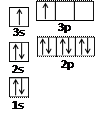 单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) |
I1 |
I2 |
I3 |
I4 |
| A |
932 |
1821 |
15390 |
21771 |
| B |
738 |
1451 |
7733 |
10540 |
(1)某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
(2)根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确 ,并阐述理由 。 (4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式 ,该物质的K原子和C60分子的个数比为 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物, 其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的电子排布式 ,该物质的K原子和C60分子的个数比为 。
(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下:
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式:。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将(“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为:、、洗涤、干燥。工业上为了充分利用锰元素,在流程中可循环使用。
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为;MnxO4中x=。
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为:。铁原子核外有种运动状态不同的电子。
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的(选填“a”或“b”)。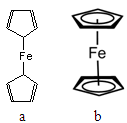
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾L。
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式,羰基硫分子属于(选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为(填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K,反应速率(均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S)d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明。
氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。
(1)现有8.4克氧化铜被氢气完全还原后,得到红色固体6.96克,其中含单质铜与氧化亚铜的物质的量之比是;
(2)若将6.96克上述混合物与足量的浓硝酸充分反应:
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是,其物质的量之比是;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体20.328g。经分析,原溶液中的Cu2+有20%残留在母液中,所得晶体的化学式为。
(3)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L HNO3溶液恰好使混合物完全溶解,同时收集到224mL NO气体(标准状况)。如原混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围(写出解题过程)。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化为烃B、烃C。以C为原料可以合成聚对羟基苯甲酸 (G)。已知:
①A是一种有机酸,分子式为C9H10O3。
②B的相对分子质量为104,分子中含苯环且能使溴的四氯化碳溶液褪色。
③C的相对分子质量为78,且分子中只有一种氢原子。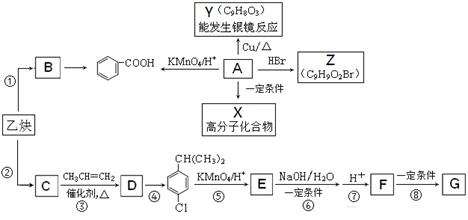
(1)写出乙炔分子的电子式, F中的含氧官能团名称;
(2)上述①至⑧的反应中,属于加成反应的有,第④步反应所需的试剂和条件是;
(3)写出A的结构简式;
(4)下列有关的描述中,正确的是;
a. 1molB最多能与4molH2加成
b. B通过氧化反应可使溴水和酸性KMnO4溶液褪色
c. B、C、D是同系物
d. A→X的反应属于缩聚反应
(5)写出F→G反应的化学方程式。