【化学-化学与技术】
电解原理在工业有广泛的应用。利用相关知识回答下面的问题。
(1)铝的阳极氧化:在进行电解以前,要对铝电极进行表面处理,是将铝片浸入热的16%NaOH溶液中半分钟左右,目的是 ,反应的离子方程式为 。铝的阳极氧化时,铝与电源的  极(填写正、负极)相连。
极(填写正、负极)相连。
(2)电解原理的运用:在右图装置中,溶液的体积为100mL,开始时电解质溶液的浓度为0.1mol/L,工作一段时间后导线上通过0.001mol电子。若不考虑盐的水解和溶液体积的变化,则电解后溶液的pH值为____________。
(3)电镀是运用电解原理,在金属表面形成一薄层有抗腐蚀、抗磨损能力的金属镀膜的过程。例如:在铜片上电镀银时,电解原理是:采用AgNO3溶液为电解质,用 作阳极。而在实际的电镀工艺中,要求金属在镀件上的析出速率得到控制,使析出的镀层厚度均匀、光滑致密、与底层金属的附着力强。所以在铁件上电镀铜时,实际使用的电镀液是 。
A.FeCl 2 2 |
B.CuCl2 | C.K6[Cu(P2O7)2] | D.CuSO4 |
(1)某元素的原子结构示意图为: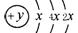 ,该元素符号为_______
,该元素符号为_______ 在周期表位于。
在周期表位于。
(2)写出下列物质的用电子式:
MgCl2:_____________。CO2:_______________。KOH________________。
下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:(无特殊说明均填元素符号、化学式等化学用语)
| 主族 周期 |
IA |
ⅡA |
IIIA |
ⅣA |
ⅤA[ |
ⅥA |
ⅦA |
0族 |
| 1 |
① |
|||||||
| 2 |
② |
③ |
④ |
|||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
|||
| 4 |
⑩ |
(1)在这些元素中,化学性质最不活泼的元素名称是,最高价氧化物对应的水化物是两性氢氧化物的元素是,⑤⑥⑩元素中原子半径最大的元素为。⑧号元素的原子结构示意图为。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是,碱性最强的化合物的化学式是,⑧、⑨号元素的氢化物中还原性较强的是。
(3)②与③形成的化合物属于(填“共价”或“离子”)化合物,。
(4)⑥号元素与水反应的化学方程式为。
制造光导纤维的原料名称是,水泥、玻璃、陶瓷属于工业,日本福岛 核电站释放的137Cs和134Cs彼此互称为,白磷和红磷互称为。
核电站释放的137Cs和134Cs彼此互称为,白磷和红磷互称为。
PC是一种可降解的聚碳酸酯类高分子材料,由于其具有优良的耐冲击性和韧性,因而得到了广泛的应用。以下是某研究小组开发的生产PC的合成路线:
已知以下信息:
①A可使溴的CCl4溶液褪色;
②B中有五种不同化学环境的氢;
③C可与FeCl3溶液发生显色反应:
④D不能使溴的CCl4褪色,其核磁共振氢谱为单峰。
请回答下列问题:
(1)A的化学名称是;
(2)B的结构简式为——;
(3)C与D反应生成E的化学方程式为;
(4)D有多种同分异构体,其中能发生银镜反应的是(写出结构简式);
(5)B的同分异构体中含有苯环的还有种,其中在核磁共振氢谱中出现丙两组峰,且峰面积之比为3:1的是(写出结构简式)。
下图是工业生产硝酸的流程。
合成塔中内置铁触媒,氧化炉中内置Pt-Rh合金网。请回答下列问题:
(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是。
(2)合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g),写出该反应的化学平衡常数表达式K=
2NH3(g),写出该反应的化学平衡常数表达式K= 。在一定温度和压强下,将H2和N2
。在一定温度和压强下,将H2和N2 按3∶1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为。
按3∶1(体积比)混合后进入合成塔,反应达到平衡时,平衡混合气中NH3的体积分数为15%,此时H2的转化率为。
(3)吸收塔中通入空气的目的是。