A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,A—J的所有物质之间有如下的转化关系(部分反应产物省略):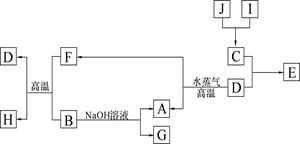
(1)B元素和C元素的简单离子半径大小关系是(用离子符号表示): _;
(2)将氮元素与C形成的化合物NC3加入水中产生使红色石蕊试纸变蓝的气体,写出该反应的化学方程式 ;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是______________ ___;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是__________________________________________________ _;
(5)向含有0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g,则加入盐酸的体积可能为______________________________(mL)。
SO2和NOx都是大气污染物。
(1)直接排放含SO2的烟气会形成酸雨,危害环境。用化学方程式表示SO2形成硫酸型酸雨的过程 。
(2)右表是某小组同学测得的不同天气情况下的某县城空气中SO2的平均含量。请你分析雨后或风速较大时SO2平均含量较低的原因:
①雨后:_________________;
②风速较大时:____________________。
(3)洗涤含SO2的烟气。以下物质不能作为洗涤剂的是________(填字母序号)。
a.熟石灰 b.纯碱 c.CaCl2 d.NaHSO3
(4)煤燃烧前需进行脱硫处理,某种脱硫技术的基本原理如下:
①该技术的第一步反应的离子方程式为 。
②处理1 kg含80% FeS2的黄铁矿,第二步消耗O2(标况)的体积为 L(保留一位小数)。
(5)某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图所示。由图可知,光化学烟雾是指等污染物气体和颗粒物所形成的烟雾。
(6)氧化—还原法消除NOx的转化如下:
①反应Ⅰ为NO+O3=NO2+O2,生成11.2 L O2(标况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,反应的化学方程式是 。
(7)利用氨水可以将SO2和NO2吸收,原理如下图所示:
NO2被吸收的离子方程式是 。
焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
(1)根据题意,可判断出X是________(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能___________(填“失去”或“得到”)_________mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: 它所对应的化学反应为: 。
它所对应的化学反应为: 。
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 |
容积/L |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
| C(s) |
H2O(g) |
H2(g) |
||||
| 甲 |
2 |
T1 |
2 |
4 |
3.2 |
8 |
| 乙 |
1 |
T2 |
1 |
2 |
1.2 |
3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填字母)。
A.="0.8" mol·L-1 B.=1.4mol·L-1C.<1.4 mol·L-1 D.>1.4mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填字母)。
A.0.6 mol 1.0 mol 0.5 mol 1.0 mol
B.0.6 mol 2.0 mol 0 mol 0 mol
C.1.0 mol 2.0 mol1.0 mol2.0 mol
D.0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
| 1.5 |
45% |
33% |
20% |
12% |
| 2.0 |
60% |
43% |
28% |
15% |
| 3.0 |
83% |
62% |
37% |
22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
Ⅰ.CO和H2作为重要的燃料和化工原料,有着十分广泛的应用。
(1)已知:C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
C(s)+H2O(g)= CO(g)+H2(g) △H2= +131.3 kJ·mol-1
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H= kJ·mol-1。
(2)利用反应CO(g) +H2(g)+O2(g) = CO2(g) +H2O(g) 设计而成的MCFS燃料电池是用水煤气(CO和H2物质的量之比为1:1)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质的一种新型电池。现以该燃料电池为电源,以石墨作电极电解饱和NaCl溶液,反应装置以及现象如图所示。则有: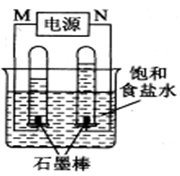
①燃料电池即电源的N极的电极反应式为 _______________________;
②已知饱和食盐水的体积为1 L,一段时间后,测得左侧试管中气体体积为11.2 mL(标准状况),若电解前后溶液的体积变化忽略不计,而且电解后将溶液混合均匀,则此时溶液的pH为 。
Ⅱ.CO和NO是汽车尾气的主要污染物。消除汽车尾气的反应式之一为:
2NO(g)+2CO(g)  N2(g)+2CO2(g)。请回答下列问题:
N2(g)+2CO2(g)。请回答下列问题:
(3)一定温度下,在一体积为VL的密闭容器中充人一定量的NO和CO时,反应进行到t时刻时达到平衡状态,此时n(CO)=amol、n(N0)=2amol、n(N2)=bmol,且N2占平衡混合气体总体积的1/4。
①该反应的平衡常数K= (用只含a、V的式子表示)
②判断该反应达到平衡的标志是____(填序号)
A.v(CO2)生成=v(CO)消耗
B.混合气体的平均相对分子质量不再改变
C.混合气体的密度不再改变
D.NO、CO、N2、CO2的物质的量浓度均不再变化
(4)在一定温度下,将2.0molNO、2.4molCO通入固定容积2L的密闭中,反应过程中部分物质的物质的量变化如图所示,则:
①有害气体NO的转化率是 ,0~15minCO2的平均反应速率v(CO2)=____(保留小数点后三位)。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件是 。(填序号)。
A.增加CO的量 B.加入催化剂 C.减小容器体积 D.扩大容器体积
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O。
(1)该电池工作时正极应通入 。
(2)该电池的负极电极反应式为: 。
(3)该电池工作时负极区溶液的pH (填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
| 实验步骤 |
实验现象及相关结论 |
| ①取少量电解质溶液于试管中,用pH试纸测其pH。 |
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
| ②继续加入()溶液,再加入()溶液,振荡。 |
若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4 |
| ③另取少量电解质溶液于试管中,滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡 |
( ) |
(5)若电池开始工作时每100mL电解质溶液含KOH 56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度( )。(结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)