在下列物质中:NaOH、Na2S、(NH4)2S、Na2O2、C2H2、SiC晶体。
⑴其中只含有离子键的离子晶体是 ;⑵其中既含有离子键又含有极性共价键的离子晶体是 ;
⑶其中既含有离子键,又含有极性共价键和配位键的离子晶体是 ;
⑷其中既含有离子键又含有非极性共价键的离子晶体是 ;
⑸其中含有极性共价键和非极性共价键的非极性分子是 ;
⑹其中含有极性共价键的原子晶体是 。
(Ⅰ)有可逆反应A(g) + 3B(g) 2C(g) △H<0
2C(g) △H<0
(1)已知该反应的平衡常数表达式:K=[C]2/[A][B]3;升高温度,平衡常数K将_______________(填“增大”,“减小”,“不变” )。([X]表示相应物质的浓度)
(2)一定条件下,该反应达平衡后,保持其他条件不变,再充入C气体,20 min后又达新平衡。试推测,与原平衡状态相比,第15 min时,V正_______(填“增大”,“减小”,“不变” ),V逆______(填“增大”,“减小”,“不变” )。
(3)该反应的速率与时间的关系如下图所示:
可见在t1、t3、t5、t7时反应都达到平衡,如果t2、t4、t6、t8时都只改变了一个反应条件,请指出改变了什么条件(例如:减小生成物的浓度)
t2时_________ ___;t4时___________;t6时__________;t8时___________。
(Ⅱ)、一定温度下在体积为5 L的密闭容器中发生可逆反应。
若某可逆反应的化学平衡常数表达式为
(1)写出该反应的化学方程式:;
(2)能判断该反应一定达到化学平衡状态的依据是(填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 |
| D.容器中总的物质的量不随时间而变化 |
E. 消耗n mol H2的同时消耗n mol CO
A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 |
元素性质或原子结构 |
| A |
单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B |
单质为生活中常见的金属,其相对原子质量比A大8 |
| C |
地壳中含量最多的金属元素 |
| D |
元素的主族序数是其所在周期序数的3倍 |
| E |
E的某种原子的原子核内没有中子 |
(1)C单质在强碱溶液反应的离子方程式是
(2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl3溶液中加入3mL 3mol/L KF溶液,ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(已知氧化性Fe3+>I2)
(填字母)。
a. A3+不与I-发生反应 b. A3+与F-结合生成不与I-反应的物质
c. F-使I-的氧化性减弱 d. A3+被F-还原为A2+,使溶液中不再存在A3+
元素周期表中,一稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层电子数为18,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高。
(1)B元素在周期表中的位置; D的最高价氧化物的水化物的化学式为______。
(2)E的气态氢化物在同族元素中沸点最高的原因是:。
(3)A、C两元素第一电离能前者后者(填“大于”或“小于”)。无论是A和C的单质还是A和C的氢化物的固体,均能与水剧烈反应生成气体,当上述四种固体分别与足量水反应时,满足n(消耗固体):n(气体):n(转移电子)=1:1:1关系的反应的化学方程式_______________。
(4)B元素能形成多种配合物,如B2+可与NH3形成配离子[B(NH3)4]2+。其配体的空间构型为;右图表示B与某种元素X形成的化合物晶胞,如果该化合物中B和X通过离子键结合,该晶体中阳离子的配位数为。若B和X通过共价键结合,则该化合物的化学式为(a ZnX b ZnX2 c ZnX3)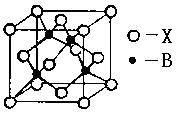
(5)A和E可形成离子化合物,其晶胞结构如图示。该化合物的电子式_______。则晶胞中与A离子距离相等且最近的E离子围成的几何体形状是_______。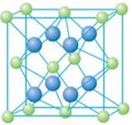
短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数与D和F原子最外层电子数之和相等;D和E是相邻两种元素。
(1)E元素基态原子的核外电子占用了个原子轨道;F元素的名称:_。
(2)A和E元素的最高价含氧酸的酸性较强的是__________;(填化学式)
(3)A、B、C三种元素组成原子个数比nA:nB:nC=1:3:2的化合物,用离子方程式表示该化合物的水溶液显碱性的原因___。
(4)B、C、D三种元素原子半径最大的是(填元素符号),离子半径最小的是(填离子符号)。M元素与D元素位于不同主族,但由于二者的电负性相近,导致某些性质相似。将M的最高价氧化物溶于C的氢氧化物的水溶液中,发生反应的离子方程式为
_。
(5)E和F形成的化合物X在高温条件下可以被氢气还原,工业上常用此反应制取高纯度的单质E,写出该化学反应的方程式。
T、X、Y、Z、Q、R、W为周期表前四周期元素,原子序数依次递增,其中某些元素的相关信息如下表:
| 元素 |
相关信息 |
| T |
T原子所处的周期数、族序数分别与其原子序数相等 |
| X |
X的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
| Z |
Z的基态原子价电子排布为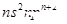 |
| Q |
在该元素所在周期中,Q的基态原子的第一电离能最小 |
| R |
3p能级上有1个电子 |
| W |
W的一种核素的质量数为65,中子数为36 |
(1)X、Y、Q三种元素的电负性由大到小的顺序是(用元素符号表示)。
(2)X与Y原子结合形成的X3Y4晶体,晶体结构与金刚石类似,则X3Y4晶体的熔点比金刚石要(填“高”、“低”)。
(3)W2+的核外电子排布式为。元素W与人体分泌物中的盐酸以及空气反应可生成超氧酸:W+HCl+O2=WCl+HO2,HO2(超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示错误的是
A.氧化剂是O2 B.HO2在碱中不能稳定存在
C.氧化产物是HO2 D.1 molW参加反应有1 mol电子发生转移
(4)X、Y、Z分别与氢元素可以构成A、B、C、D等多种粒子。其中A、B、C均为10电子微粒,D为18电子微粒。A为5原子核的+1价阳离子,则A+的中心原子杂化方式为_______. B为4原子核的+1价阳离子,则B+电子式为___________。C为4个原子核构成的分子,则与C互为等电子体的分子可以是_______(写结构式)。D分子中两元素的原子个数之比为1:1,则D为(填“极性”或“非极性”)分子。某双原子单质分子E也为18电子微粒,E与水的反应的化学方程式为______________________。
(5)已知25℃、101 kPa条件下:
4R(s)+3Z2(g)2R2Z3(s)△H=-2835.9 kJ/mol
4R(s)+2Z3(g)2R2Z3(s)△H=-3119.1 kJ/mol
则16g Z2(g)完全转化为Z3(g)的△H=.