下图是工业生产硝酸铵的流程。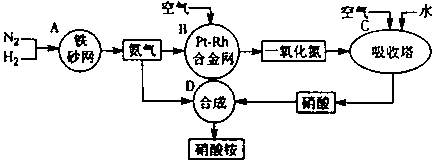
(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H = —1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=" " +180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知: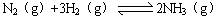 △H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
△H= —92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为 。
某课外活动小组去一家废旧金属回收公司辨别生铁和废钢,他们运用所学的生铁和钢的性能、用途等有关知识进行辨别,收获很大。试问:该课外活动小组可能是用哪些较简单的方法辨别生铁和废钢的?(只答方法,不必叙述理由)_________________________________。
将一块铝硅合金恰好与NaOH溶液完全反应而溶解。
(1)写出合金溶解的离子方程式______________________________________________。
(2)向所得的溶液中加入足量的盐酸,充分反应后,溶液中大量存在的离子为_______。
近年来,为满足某些尖端技术的发展需要,人们又设计和合成了许多新型合金材料。如:储氢合金是一类能够大量吸收氢气,并与氢气结合成金属氢化物的材料。此外,________、________和________等新型合金广泛应用于卫星、航空航天、生物工程和电子工业等领域。
2013年4月20日08时02分四川省雅安市芦山县(北纬30.3度,东经103.0度)发生7.0级强震,震源深度13千米,给灾区的人民造成了巨大的生命和财产损失。
(1)下列说法正确的是________。
| A.植物油在稀硫酸和NaOH溶液中发生水解,所得产物相同 |
| B.医生向废墟中病人输液的主要目的是向体内输入葡萄糖、生理盐水等营养物质 |
| C.大米的主要成分是淀粉,适合所有灾区灾民食用 |
| D.合理食用蔬菜能增强灾民的身体素质 |
(2)为了抢救灾区人员的生命,大量医务人员进入灾区进行防疫和开展治疗工作。某药品标签上贴有OTC,它表示________,若是R标记则表示________,我们平时能自己到药店买到的药如阿司匹林属于哪类药________。某青霉素的结构为: (R不同可形成不同的青霉素),本次抢救伤员中,使用的六种青霉素所对应R的结构如下:
(R不同可形成不同的青霉素),本次抢救伤员中,使用的六种青霉素所对应R的结构如下:
| 青霉素 |
—R |
| A |
CH3CH2CH=CHCH2CH2— |
| B |
 |
| C |
CH3—(CH2)4— |
| D |
CH3CH=CH—C(CH3)2— |
| E |
 |
| F |
CH3—(CH2)6— |
根据表中六种青霉素回答下列问题:
①青霉素F的分子式为________。
②属于同分异构体的是________,属于同系物的是________。
③只用一种试剂就可把其中某种青霉素鉴别出来,该试剂为________。
抗酸药物的种类很多,其有效成分一般都是碳酸氢钠、碳酸钙、碳酸镁、氢氧化铝和氢氧化镁等化学物质。
(1)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。写出该抗酸药发挥功效时的化学方程式__________________、__________________。
(2)淀粉在抗酸药中作填充剂、黏合剂,淀粉在人体内酶的催化作用下发生水解反应,最终转化为(写分子式)____________。
(3)服用抗酸药时,为什么一般要嚼碎后吞服?_________________________________。