一定温度下,在容积为 VL的密闭容器中进行反应:aN(g)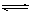 bM(g),M、 N的物质的量随时间的变化曲线如图所示:
bM(g),M、 N的物质的量随时间的变化曲线如图所示: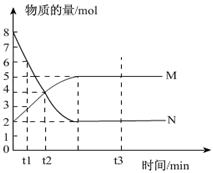
(1)此反应的化学方程式中a/b =" __________"
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为:______________
(3)下列叙述能说明上述反应达到平衡状态的是
______________(填序号)
| A.反应中M与N的物质的量之比为1︰1 |
| B.混合气体的总质量不随时间的变化而变化 |
| C.混合气体的总物质的量不随时间的变化而变化 |
| D.单位时间内每消耗a mol N,同时生成b mol M |
E.混合气体的压强不随时间的变化而变化
(1)有人将铂丝插入KOH溶液中做电极,并在两极片上分别通入甲烷和氧气,形成一种燃料电池,在该电池反应中,甲烷发生类似于燃烧的反应,根据以上判断:
①通甲烷的铂丝为原电池的______极,发生的电极反应为____________________。
②该电池工作时(放电)反应的总化学方程式为_______________________________。
(2)X、Y、Z为三种不同短周期非金属元素的单质。在一定条件下发生如下反应:若常温下Y为固体,X、Z为气体,A在空气中充分燃烧可生成B,则:
①B的化学式为;
②向苛性钠溶液中通入过量的A所发生反应的离子方程式为
③将B与氯气的水溶液充分反应可生成两种强酸,该反应的化学方程式为
已知有机物 A、B、C、D、E、F之间的转化关系如图所示。D 是常用做汽车发动机的抗冻剂,E为聚合物,F的式量为26。根据信息回答下列问题。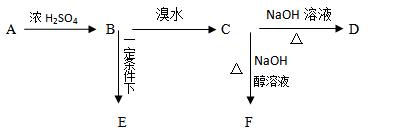
(1)写出A中官能团名称
(2) B转化为C的反应类型
(3)有机物D具有以下哪几方面的化学性质:(填序号)
①加成反应②取代反应③消去反应④氧化反应⑤还原反应
(4) E的结构简式为
(5) C—F反应的方程式
烷烃A(MA = 86)只有三种一氯取代产物B、C和D。 B和D分别与强碱的醇溶液共热,都只能得到有机化合物E。以上反应及B的进一步反应如下图所示。 请回答:
请回答:
(1)G的结构简式是。
(2)B—F的反应条件。
(3)B转变为E的反应属于(填反应类型名称)。
(4)F与I的关系是。
(5)写出反应H与I的反应方程式。
2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为: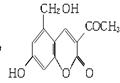
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。写出其属于醇类的同分异构体的结构简式
_______________________________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与2 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式。
有机物A的分子式为C9H10O2,A在光照条件下生成的一溴代物B,可发生如下转化关系(无机产物略):([ O ]指发生氧化反应)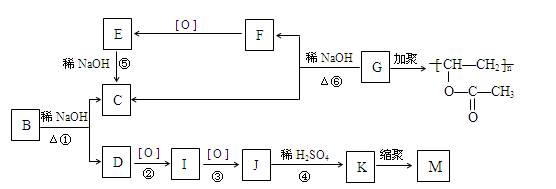
其中K与FeCl3溶液能发生显色反应,且环上的一元取代物只有两种结构。
已知:① 当羟基与双键碳原子相连时,易发生如下转化:
RCH="CHOH" à RCH2CHO。
② —ONa连在烃基上不被氧化。
请回答下列问题:
(1)F与I中具有相同的官能团,检验该官能团的试剂是。
(2)上述变化中属于水解反应的是(填编号)。
(3)写出结构简式:G;M。
(4)写出下列反应的化学方程式:反应①;K与NaHCO3溶液反应。
(5)写出同时符合下列要求的A的同分异构体的结构简式。
I.含有苯环II.能发生银镜反应和水解反应
III.在稀的NaOH溶液中,1mol该同分异构体能与1mol NaOH反应