向体积为10 L的固定密闭容器中通入3 mol X气体,在一定温度下发生如下反应:
2X(g)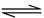 Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min后反应达到平衡Ⅰ,此时测得容器内的压强为起始时的1.2倍,则且Y表示的反应速率为 mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内反应速率分别为:甲: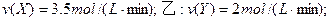 丙:
丙: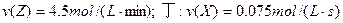 。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
。若其它条件下同,温度不同,则温度由高到低的顺序是(填序号) ;
(3)若向Ⅰ的平衡体系中充入氮气,则平衡 (填“向左”或“向右”或“不”)移动;若将Ⅰ的平衡体系中部分混合气体移走,则平衡 (填“向左”或“向右”或“不”)移动;
(4)若在相同条件下向Ⅰ的平衡体系中再充入0.5 mol X气体,则原平衡Ⅰ中X的转化率与重新平衡后X的转化率相比较 (选填字母)。
| A.无法确定 | B.前者一定大于后者 |
| C.前者一定等于后者 | D.前者一定小于后者 |
(5)若保持温度不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol,达到平衡时各气体体积分数与Ⅰ平衡相同,且起始时维持化学反应向逆反应方向进行。则c的取值范围应该为 。
(本体包括I、II两部分,共14分)
【I】工业上用CO2和NH3为原料合成尿素,尿素的化学式为CO(NH2)2。尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(III),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的第一电离能由大到小的顺序是.
(2)尿素分子中C和N原子的杂化方式分别是。
(3)NH4+中H—N—H键角比NH3中H—N—H键角大,原因为.
【Ⅱ】在元素用期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7。其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层层电子数为18.E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点量高。
(4))B元素在周期表中的位置;D元素的价电子排布式为.
(5)已知B离子类似Cu2+与NH3形成配合离子,且两者配位数也相同,1mol该配离子中含有molσ键。
(6)A元素可与E元素形成离子化合物,它的晶胞如图所示,E离子的配位数为。每个A离子周围与之最近等距的A离子有个.
(7)已知铜元素能形成多种化合物。
①CuSO4·5H2O也可写成[Cu(H2O)4]SO4·H2O,其结构示意图如下图所示。下列说法正确的是(填字母).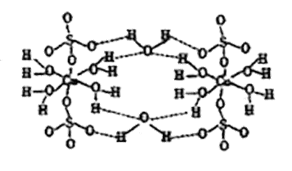
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCD-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95。已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为—2价、Cu为+2价和+3价。则该化合物中+2价Cu和+3价Cu的原子个数之比为.
[化学选修5—有机化学基础] (15分)
紫杉醇(paclitaxel)是一种抗癌药,化合物D是紫杉醇的侧链,D的合成路线如图: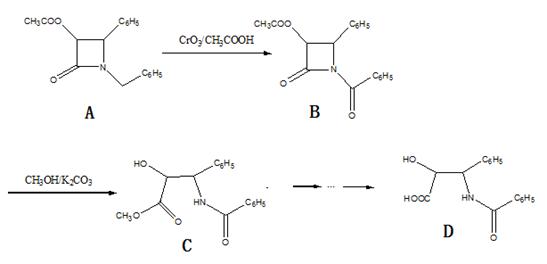
(1)B的分子式为_______;D的水解产物中所含官能团的名称为_____________________。
(2)已知酯和酰胺在过量醇中能发生醇解反应:
CH3COOC2H5+CH3OH CH3COOCH3+C2H5OH
CH3COOCH3+C2H5OH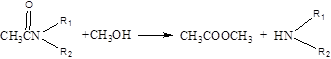
A-B的反应类型为_______________,B-C的反应类型为_______________。
(3)B-C反应的另一产物为______________________(写结构简式)
(4)A的合成应用了2010年诺贝尔化学奖的获奖成果﹣﹣交叉偶联反应,反应式如下(已配平):
CH3COOCH2COCl+X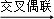 A+HCl,X分子中含碳氮双键(C=N),其结构简式为.
A+HCl,X分子中含碳氮双键(C=N),其结构简式为.
(5)若最后一步水解的条件控制不好,D会继续水解生成氨基酸E和芳香酸F.
①写出D在NaOH溶液中发生水解的化学反应方程式_________________________.
②E在一定条件下能发生缩聚反应,写出所得高分子化合物的一种可能的结构简式:
③F的同分异构体中,属于芳香族化合物、能发生银镜反应的有______种.
Ⅰ.制水煤气的主要化学反应方程式为:C(s)+H2O(g) CO(g)+H2(g),此反应是吸热反应。
CO(g)+H2(g),此反应是吸热反应。
①此反应的化学平衡常数表达式为;
②下列能提高碳的平衡转化率的措施是。
| A.加入C(s) |
| B.加入H2O(g) |
| C.升高温度 |
| D.增大压强 |
E.将碳研成粉末
Ⅱ.研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为:
________________________________________________________________。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是:
________________________________________________________________。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1所示,该电池反应的离子方程式为:_____________________________________________________________。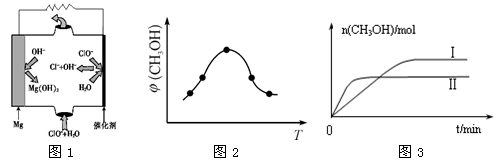
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g)△H
CH3OH(g) +H2O(g)△H
①取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH__________(填“>” “<”或“=”)0。
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ 对应的平衡常数大小关系为KⅠ__________________KⅡ(填“>” “<”或“=”)。
③一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为____________________。
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于38℃时析出晶体是NaClO2•3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。现利用图所示装置进行实验。
(1)装置③的作用是。
(2)装置②中产生ClO2的化学方程式。
装置④中制备NaClO2的化学方程式为。
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶;
②趁热过滤;
③;
④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,在滴入适量的稀硫酸,充分反应后,加蒸馏水至250mL
(已知:ClO2- + 4I- + 4H+ = 2H2O + 2I2 + Cl-);
②移取25.00 mL待测液于锥形瓶中,加几滴淀粉溶液,用c mol×L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值V mL(已知:I2 + 2S2O32- = 2I- + S4O62-)。
(4)达到滴定终点时的现象为。
(5)该样品中NaClO2的质量分数为(用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为
。
已知A为一种盐,隔绝空气加热的条件下发生下述变化,C、D、F、N、O为无色气体,E常温常压下为无色无味的液体,N、H、L为常见的单质,I为常见的无氧强酸,M的焰色反应为紫色,反应①常用于气体F的检验。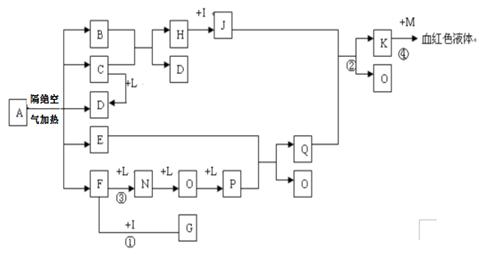
(1)写出G的电子式____________________,M的化学式_________________。
(2)写出反应②的离子反应方程式_________________________________。
(3)写出反应③的化学反应方程式_______________________,反应①—④中属于非氧化还原反应的是_______________。
(4)用石墨电极电解溶液K时,电解初始阶段电极反应方程式为:
阴极:___________________________
阳极:__________________________________
(5)已知A在隔绝空气条件下分解产生的各产物的物质的量之比为
B:C:D:E:F=1:2:2:1:2,写出A分解的化学反应方程式____________________________。