测定慕硫酸锄黑体(Na2SO4·XH2O)中结晶水含量韵实验包括如下两步:
①将硫酸钠晶体制成粉末,准确称取该样品26.8 g
②将样品加热至恒重,冷却后称得样品质量变为14.2 g
试回答下列问题:
(1)将晶体制成粉末,所用的主要化学仪器是____(填仪器名称,下同);准确称量后将样品放在 中加热至恒重。
(2)判断试样已加热至恒重的标准是________。
(3)根据实验数据计算出x=____。
(4)下面的情况有可能造成测定结果偏低的是 (填序号)。
| A.试样中含有加热易挥发的杂质 | B.加热后不是在于燥器中冷却试样 |
| C.实验前坩埚来完全干燥 | D.加热时有晶体溅出 |
E.试样中含有加热不挥发的杂质
A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中只有C为金属元素,A、C与B、D分别是同主族元素,又知B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数和的2倍,这四种元素的单质中有2种气体,2种固体。
(1)写出元素符号:A,B,C,D。
(2)在由A、B、C、D四种元素两两组成的二元化合物中,非极性分子有;其结构中存在非极性键的分子晶体有;其结构中存在非极性键的离子晶体有__________;(各填一种物质的化学式)
(3)写出两种均含有A、B、C、D四种元素的化合物两种:、。
把淀粉溶液溶于沸水中,制成淀粉胶体。
(1)鉴别水溶液和胶体可以利用的方法是
。
(2)60℃左右时,在淀粉胶体中加入淀粉酶,充分反应。然后把反应后的全部液体装入半透膜袋里,系紧袋口,并把它悬挂在盛有蒸馏水的烧杯里。从半透膜袋里析出的物质是,该操作的名称是。
(8分)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(不需配平)_________________。
(3)上述反应中,氧化剂是________,1 mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:
________________________________________________________________________。
氯离子插层镁铝水滑石[Mg2Al(OH)6Cl•xH2O]是一种新型离子交换材料,其在高温下完全分解为MgO、 Al2O3、HCl和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。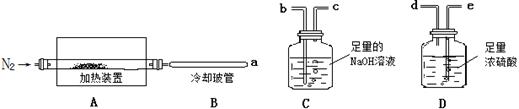
(1)Mg2Al(OH)6Cl•xH2O热分解的化学方程式为。
(2)若只通过测定装置C、D的增重来确定 ,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
,则装置的连接顺序为(按气流方向,用接口字母表示),其中C的作用是。装置连接后,首先要进行的操作名称是。
(3)加热前先通过N2排尽装置中的空气,反应完成后,再持续通入N2的作用是。
(4)完全分解后测得C增重3.65g、D增重9.90g,则 =.
=.
(10分)Ⅰ.已知NaHS04是一种酸式盐,在工业上应用广泛,根据NaHS04的性质回答下列问题:
(1)写出NaHS04在水溶液中的电离方程式:
(2)若向NaHS04溶液中滴加Ba(OH)2至SO42-完全沉淀时的离子方程式为
(3)滴加Ba(0H)2溶液使溶液呈中性时的化学方程式为
Ⅱ.(4)若在标准状况下,将V L HCl气体溶于lL水中,所得溶液密度为dg/ml,则此溶液的物质的量浓度为
(5) 一定质量的铝铁合金溶于足量的NaOH溶液中,完全反应后产生3.36 L(标准状况下)气体;用同样质量的铝铁合金完全溶于足量的盐酸中,在标准状况下产生5.6 L(标准状况下)的气体,则该合金中铝、铁的物质的量之比为