现配制500mL0.5moI/L的NaOH溶液
(1)需要的仪器除用量筒、烧杯、玻璃棒外,(2)还需要的玻璃仪器有__________.
(3)用托盘天平称量氢氧化钠固体时, (4)应在小烧杯里应称量___克氢氧化钠.
(5)配制过程主要有:溶解、_____、转移、______、加水稀释、定容、摇匀,而
(6)后转移到试剂瓶里并贴上标(7) 签。(8)若取上述溶液100mL,(9)其物质的量浓度为________(10)如果其它各项操作均正常,(11) 仅有一项下列操作时,(12)对配制结果有何影响(填偏高、偏低、无影响或无法确定)?定容时俯视刻度线________.配制前容量瓶不干燥_______.定容后摇匀时有液体贱出______.
(4分)有下列几组物质,请将序号填入下列空格内:
| A.CH2=CH-COOH和油酸(C17H33COOH) |
| B.C60和石墨 |
C. 和 和 |
| D.35Cl和37Cl |
E.乙醇和乙二醇
①互为同位素的是 ;②互为同系物的是 ;
③互为同素异形体的是 ;④互为同分异构体的是 ;
I.还原剂还原法、光催化氧化法、电化学吸收法是减少氮氧化物排放的有效措施。
(1)利用炭粉可以将氮氧化物还原。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.6 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
反应:C(s)+2NO(g)=CO2(g)+N2(g)ΔH=_____kJ·mol-1。
(2)TiO2在紫外线照射下会使空气中的某些分子产生活性基团OH,OH能将NO、NO2氧化,如下图所示,OH与NO2的反应为NO2+OH=HNO3。
写出OH与NO反应的化学方程式:_____________。
II.甲醇、乙醇是重要的有机化工原料,有着重要的用途和应用前景。
(3)若在恒温恒容的容器内进行反应CO(g)+2H2(g) CH3OH(g),则可用来判断该反应达到平衡状态的标志有(填字母)。
CH3OH(g),则可用来判断该反应达到平衡状态的标志有(填字母)。
| A.H2百分含量保持不变 |
| B.容器中气体的压强保持不变 |
| C.容器中混合气体的密度保持不变 |
| D.2v(H2)正= v(CH3OH )逆 |
(4)CO(g)+2H2(g) CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,
CH3OH(g) 其平衡常数表达式为K=___________。该反应的平衡常数K 随温度T 的变化如图所示,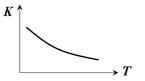
则该反应的 △H0。(填“>”、“<”或“=”)。已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(5)下图所示是一种酸性燃料电池乙醇检测仪,具有自动吹气流量侦测与控制的功能,适合进行现场乙醇检测。负极反应式为_________。
在精制饱和食盐水中加入碳酸氢铵,可制取小苏打(NaHCO3)并提取氯化铵作为肥料或进一步提纯为工业氯化铵。完成下列填空:
(1)写出上述制备小苏打的化学方程式
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,一段时间后将溶液加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是________________;滤渣的主要成分是_________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。选甲基橙而不选酚酞作为指示剂的原因是__________。
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
(16分)工业上利用(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵)、H2C2O4(草酸)、K2C2O4(草酸钾)、双氧水等为原料制备K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾晶体)的部分实验过程如下:
反应的原理如下:
沉淀:(NH4)2Fe(SO4)2·6H2O+H2C2O4 FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
FeC2O4·2H2O↓+(NH4)2SO4+H2SO4+4H2O
氧化:6FeC2O4+3H2O2+6K2C2O4 4K3[Fe(C2O4)3]+2Fe(OH)3
4K3[Fe(C2O4)3]+2Fe(OH)3
转化:2Fe(OH)3+3H2C2O4+3K2C2O4 2K3[Fe(C2O4)3]+6H2O
2K3[Fe(C2O4)3]+6H2O
(1)溶解的过程中要加入几滴稀硫酸,目的是。
(2)沉淀过滤后,用蒸馏水洗涤,检验洗涤是否完全的方法是。
(3)在沉淀中加入饱和K2C2O4溶液,并用40 ℃ 左右水浴加热,再向其中慢慢滴加足量的30%H2O2溶液,不断搅拌。此过程中温度不宜过高的原因可能是。
(4)为测定该晶体中铁的含量,该工厂化验室做了如下实验:
步骤一:称量5.00 g三草酸合铁酸钾晶体,配制成250. 00mL溶液。
步骤二:取所配溶液25.00 mL于锥形瓶中,加稀硫酸酸化,滴加KMnO4溶液至草酸根离子恰好全部氧化成二氧化碳。向反应后的溶液中加入足量锌粉,Fe3+被还原为Fe2+。然后过滤、洗涤,将滤液及洗涤液一并转入锥形瓶,此时溶液仍呈酸性。
步骤三:用标准KMnO4溶液滴定步骤二所得溶液中的Fe2+,记录消耗KMnO4溶液的体积(滴定中MnO4—被还原成Mn2+)。
步骤四: ……
步骤五:计算,得出结论。
请回答下列问题:
① 步骤一中需要用到的玻璃仪器有烧杯、量筒、玻璃棒、、
② 步骤二中若加入KMnO4的量不足,则测得铁含量(填“偏低”、“偏高”或“不变”);
③ 写出步骤三中发生反应的离子方程式:
④ 请补充步骤四的操作:
橙皮素具有抗氧化、消炎、降血脂、保护心血管和抗肿瘤等多种功效。它的合成路线如下: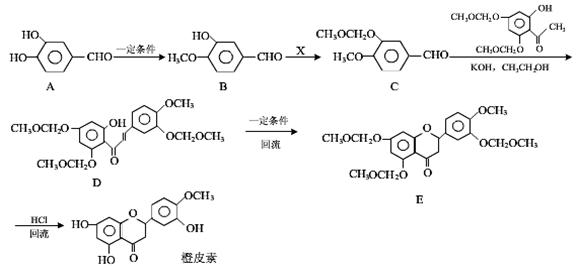
⑴化合物A中的含氧官能团除酚羟基外还有(填官能团名称)。
⑵已知:B→C为取代反应,其另一产物为HCl,写出X 的结构简式:。
⑶反应D→E的反应类型是。
⑷写出同时满足下列条件的B的同分异构体的结构简式:。
Ⅰ.属于芳香族化合物;
Ⅱ.分子中有4种不同化学环境的氢;
Ⅲ.不能与FeCl3溶液发生显色反应,但能发生水解反应。
⑸如何由CH3CH2CH2Br制备CH3CH(OH)CH2OH,请设计流程图并写出每一步的化学方程式
(合成路线流程图示例如下: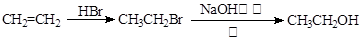 )
)