(1)某有机物含有C、H、O三种元素。经燃烧分析实验测定其碳的质量分数是64.86%。下图是该有机物的质谱图。则该有机物的分子式为 
(2)完全燃烧某有机物4.3 g生成4.48 L(标准状况)CO2和2.7 g H2O。则该有机物的实验式为
回答下列问题:
(1)某溶液可能呈酸性或碱性,此外还有Na+、SO42-和Cl-,且测得此三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和0.004 mol·L-1,该溶液的pH为 。
(2)在浓NH4Cl溶液中加入镁单质,会产生气体,该气体成分是 。
(3)液氨类似于水的电离,试写出液氨的电离方程式 。
(4)某二元酸(H2A)在水中的电离方程式是:H2A=H++HA- , HA- H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
H++A2-,用离子方程式表示Na2A溶液呈酸碱性的原因:
五种不同元素X、Y、Z、D、E、F的信息如下:
| 元素 |
有关信息 |
| X |
元素主要常见化合价为-2和-1价,原子半径为0.074 nm。 |
| Y |
所在主族序数与所在周期序数之差为4。 |
| Z |
原子半径为0.102 nm,核外最外层电子数是其电子层数的2倍,其气态氢化物与Y单质发生反应生成淡黄色固体。 |
| D |
最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子。 |
| E |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。 |
| F |
元素所在的主族序数等于周期序数。 |
请回答下列问题:
(1)Z在周期表中的位置_________,D的最高价氧化物对应水化物的电子式为__________
(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为 。
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是 (用离子方程式表示)。
(4)E单质在发生吸氧腐蚀时的正极反应方程式
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理
大家知道:Cu+H2SO4(稀)= Cu SO4+H2通常不能反应。请回答:
(1)试说明此反应在一般情况下不能发生反应的原因是_________________。
(2)根据你所学过的知识,设法使其中的反应能发生,具体的方法是_________________;反应原理是:阳极__________________________
阴极__________________________
(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式:________________________,已知 H2O(l) = H2O(g) ΔH = +44 kJ·mol-1,则标准状况下33.6 L H2生成液态水时放出的热量是 kJ 。
(2)已知反应:H2(g)+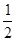 O2(g)==H2O(g)△H1
O2(g)==H2O(g)△H1
N2(g)+2O2==2NO2(g)△H2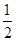 N2(g)+
N2(g)+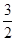 H2(g)==NH3(g)△H3
H2(g)==NH3(g)△H3
利用上述三个反应,计算4NH3(g)+7O2(g)==4NO2(g)+6H2O(g)的反应焓变为__________________(用含△H1、△H2、△H3的式子表示)。
在400℃时,将一定量SO2和14molO2投入一个盛有催化剂的10L密闭容器中进行反应2SO2+O2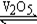 2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后容器中剩余2molSO2和12molO2,则:
(1)生成了_______ mol SO3, SO2起始物质的量的浓度是________ mol/L―1。
(2)V(SO2)是_______ mol/L―1.min―1, V(SO3)是_________ mol/L―1.S―1。