25℃时,物质的量浓度相等的CH3COOH和NH3·H2O的稀溶液,两者pH之和为14。
有一种并不常用的酸碱指示剂,是中性红和次甲基蓝在酒精中的混合溶液,称为“中性红-次甲基蓝混合指示剂”,它恰好能在pH=7时在溶液中呈紫蓝色,在酸性溶液中呈紫色,在碱性溶液中呈绿色。
(1)已知0.05mol·L-1NH4Cl溶液的pH=5.3,试推断0.05 mol·L-1CH3COONa溶液的pH为____。
(2)用NaOH标准溶液(准确浓度接近0.1 mol·L-1)测定待测的CH3COOH溶液浓度的实验方案中,试回答下列问题:
①中性红-次甲基蓝混合指示剂________(填“能”或“不能”)用于本实验的滴定?说明理由
________________________________________________________________________。
②常用的酸碱指示剂中__________适用于本实验的滴定。判断滴定终点的方法是________
____________________________________________________________________。
(10)(1)氯碱工业是利用电解食盐水生产①为基础的工业体系。
(2)电解前,为除去食盐水中的Mg2+、Ca2+、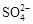 等杂质离子,下列加入顺序合理的是②。
等杂质离子,下列加入顺序合理的是②。
| A.碳酸钠、氢氧化钠、氯化钡 | B.碳酸钠、氯化钡、氢氧化钠 |
| C.氢氧化钠、碳酸钠、氯化钡 | D.氯化钡、氢氧化钠、碳酸钠 |
(3)“盐泥”是粗盐提纯及电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 |
NaCl |
Mg(OH)2 |
CaCO3 |
BaSO4 |
其他不溶于酸的物质 |
| 质量分数(%) |
15~20 |
15~20 |
5~10 |
30~40 |
10~15 |
为生产七水硫酸镁,设计了以下工艺流程: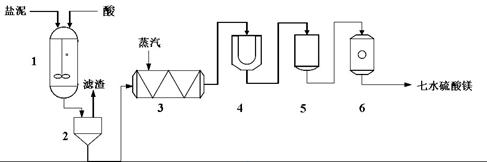
生产七水硫酸镁工艺流程图
1-反应器 2-过滤器 3-蒸发浓缩器 4-结晶槽 5-洗涤槽 6-真空干燥器
装置1中加入的酸应选用③,加入的酸应适当过量,控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,在此过程中同时生成CaSO4。其中碳酸钙可以转化为硫酸钙的原因是④。
装置2中滤渣的主要成分为⑤。
装置3中通入高温水蒸汽并控制温度在100~110℃,蒸发结晶,此时析出的晶体主要是__⑥__。
用装置6(真空干燥器)干燥七水硫酸镁晶体的理由是⑦。
(10)(1)可正确表示原子轨道的是:①。
A.2s B.2d C.3pz D.3f
(2)写出原子序数31的基态镓(Ga)原子的电子排布式:②。
(3)下列物质变化,只与范德华力有关的是③。
A.干冰熔化 B.乙酸汽化
C.乙醇与丙酮混溶 D.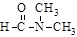 溶于水
溶于水
E.碘溶于四氯化碳 F.石英熔融
(4)下列物质中,只含有极性键的分子是④,既含离子键又含共价键的化合物是⑤,
只存在σ键的分子是⑥,同时存在σ键和π键的分子是⑦。
A.N2 B.CO2 C.CH2Cl2 D.C2H4 E.C2H6 F.CaCl2 G.NH4Cl
(5)用“>” “< ” “=” 填空:
第一电离能的大小:Mg⑧Al;熔点的高低:KCl⑨MgO。
m、n、x、y四种主族元素在周期表的相对位置如下图所示。已知它们的原子序数总和为46,则: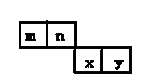
(1)元素n的气态氢化物的分子式为,空间构型为,n原子的价电子排布式是_______
(2)m与y所形成的化合物含键,属分子。(填“极性”或“非极性”)
(3)x位于周期表的第周期第族;其简单离子的离子结构示意图为。
(4)由n、y的氢化物相互作用所生成的物质的电子式为。
(10分)X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种元素为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题:
(1)Y、Z、W的原子半径由小到大的顺序是________。
(2)ZW2的电子式是________。
(3)工业生产单质Y的原理是________________________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是______________________。
(5)0.1 mol的单质W与50 mL 1.5 mol·L-1的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是________。
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行下列实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加足量NaOH溶液加热后,收集到0.04mol气体;
③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤,干燥后,沉淀质量为2.33g;根据上述实验,推测100mL该溶液中一定存在的离子以及计算这些离子的物质的量。