某化合物A经碱性水解后得到B,酸化后得到C(C8H8O2)。核磁共振氢谱表明,C含有苯环,且苯环上有2种氢原子。B经过下列各步反应后得到G(C8H12O4),核磁共振氢谱显示G中只有1种氢原子。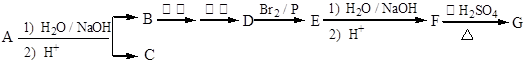
已知: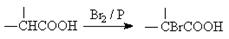
请回答下列问题:
(1)有机物类别:A物质属于______类,C物质属于________类。
(2)写出满足下列条件的C的所有同分异构体:__________________________________________。
①是苯的对位二取代化合物;②能与FeCl3溶液发生显色反应;③不考虑烯醇( )结构。
)结构。
(3)写出F→G反应的化学方程式:_____________________________________________________。
(4)写出A的结构简式:_____________________________________。
(5)在G的粗产物中,经检测含有聚合物杂质。写出聚合物杂质可能的结构简式(仅要求写出1种):__________________________________。
⑴常温、101kPa,15g乙烷完全燃烧放出的热量为390.2 kJ,则乙烷完全燃烧的热化学方程式为:
⑵把煤作为燃料可通过下列两种途径:途径Ⅰ:C(s)+O2(g)=CO2(g)ΔH1<0①途径Ⅱ:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g)ΔH2>0 ②
再燃烧水煤气:CO(g)+  O2(g)=CO2(g)ΔH3<0 ③
O2(g)=CO2(g)ΔH3<0 ③
H2(g)+  O2(g)=H2O(g)ΔH4<0④
O2(g)=H2O(g)ΔH4<0④
请回答下列问题:
①途径Ⅰ放出的热量__________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
②用ΔH2、ΔH3、ΔH4表示ΔH1的数学关系式是_______________
按要求写出有关氧化还原反应的化学方程式,并指出氧化剂和还原剂。
⑴ 是化合反应,也是氧化还原反应
___________________________________________________________________________
氧化剂:____________还原剂:_____________
⑵ 有金属单质Cu生成的置换反应
_________________________________________________________________________
氧化剂:____________还原剂:_____________
写出下列反应的离子方程式:
⑴ Fe2O3与稀盐酸反应:________________________________________
⑵ 稀硫酸与氢氧化铜反应:________________________________________
⑶ 氯化钡溶液中滴入硫酸钠溶液:________________________________________
制备氢氧化铁胶体的方法是
,可通过来区别溶液和胶体。
现有以下物质:①KOH固体②液态HCl ③盐酸 ④熔融KCl ⑤蔗糖 ⑥铜⑦CO2 ⑧H2SO4
请将序号填在横线上
⑴ 以上物质中能导电的是________,
⑵ 以上物质中属于电解质的是________,
⑶ 以上物质中属于非电解质的是_____。