X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素的常见单质在常温下都是无色气体,在适当条件下可发生如图变化: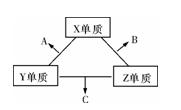
一个B分子中含有的Z原子个数比C分子中少1个,B、C两种分子中的电子数均等于10。
请回答下列问题:
(1)X元素在周期表中的位置是 周期 族。
(2)①C在一定条件下反应生成A的化学方程式是 。
②X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W吸收生成一种盐。该盐的水溶液pH 小于 7(填“大于”、“小于”、“等于”),其原因是(写出离子方程式)
。
(3)已知Y单质与Z单质生成C的反应是可逆反应,ΔH<0。将等物质的量的Y、Z两种单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的有 。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,Y、Z两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡后,升高温度,C的体积分数增大
已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: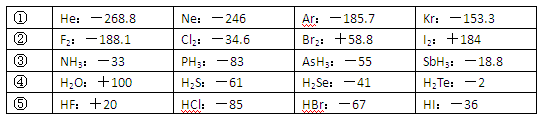
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是(任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围(填“物质的化学式”)。
铁元素的化合价有+2、+3两种,磁铁矿的主要成分是Fe3O4,能与盐酸反应生成两种盐。
(1)请用铁的+2价、+3价的氧化物形式表示Fe3O4可写成___________________
(2)写出Fe3O4与盐酸反应的离子方程式_________________。
(3)设计实验验证反应后溶液中含有Fe3+所用的试剂和反应的化学方程式__________、______________。
(4)设计实验验证反应后溶液中不含Fe3+而可能含有Fe2+。进行实验操作的顺序有:①加入足量氯水,②加入足量高锰酸钾溶液,③加入少量硫氰化钾溶液,选择所需要的试剂及先后的顺序是______________(注意先后顺序)。
(5)将反应后的溶液中Fe3+全部转化为Fe2+,最适宜的物质是选用___________。
(6)将反应后的溶液中Fe2+全部转化为Fe3+,选用的绿色试剂是H2O2 ,H2O2在酸性的条件下将Fe2+氧化为Fe3+,写出反应的离子方程式___________________。
氮氧化物(如NO2、NO等)进入大气后,不仅会形成硝酸型酸雨,还可能形成光化学烟雾.因此必须对含有氮氧化物的废气进行处理.
(1)用氢氧化钠溶液可吸收废气中的氮氧化物.反应的化学方程式如下:
NO2 +NO+2NaOH═2NaNO2+H2O①2NO2 + 2NaOH═NaNO2+ NaNO3+ H2O②
在反应①中,产物NaNO2中N元素的化合价为,氧化剂与还原剂的质量之比为;在反应②中,氧化剂是,还原剂是。
(2)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使他们发生反应生成无毒气体,该反应的化学方程式为。
(3)亚硝酸钠
氨气(NH3)也可用来处理氮氧化物.例如,氨气与二氧化氮反应:8NH3+6NO2═7N2+12H2O.
若某工厂排出废气中NO2含量为0.5%(体积分数),则处理1.0×103米3(标准状况)这种废气,需要 千克氨气 (计算结果保留2位小数)。
实验室中的Na2SiO3溶液长期放置,瓶底会出现白色沉淀,形成沉淀的离子方程式是。取瓶中的上层清液滴入稀盐酸,既有气泡又有沉淀生成,其离子方程式为,。
浓硫酸在下列用途和现象中所表现的性质是
| A.沸点高、难挥发 | B.酸性 | C.吸水性 | D.脱水性 E.强氧化性 |
