回答下列各小题:
(1)已知NaHSO4在水中的电离方程式为 NaHSO4= Na+ + H+ + SO42- 。在NaHSO4溶液中c(H+) c(OH-)+ c(SO42-)(填 “>”、“=”或“<”)。
(2)常温下,向1.0mol / L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。
其中b点所示溶液呈 (填“酸性”、“中性”或“碱性”),c点所示的离子方程式为 。
(3)在t℃时,将NaHSO4晶体加入到pHH= 6的蒸馏水中,保持温度不变,测得溶液的pHH为2。t℃将 25℃(填“高于”或“低于”),Kw= ,在该溶液中由水电离出的c(H+)为 mol / L。t℃时,将pH =11的NaOH溶液V1L与pH =1的H2SO4溶液V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH =2,则V1∶V2 = ,此溶液中各种离子的浓度由大到小的排列顺序为 。
(4)在0.1mol / L的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4HSO4溶液、④NH4Cl溶液中,c (NH4+)由大到小的排列顺序为 。(用序号填空)
CO和H2可作为能源和化工原料,应用十分广泛。
(1)已知:C(s)+O2 (g) ===CO2(g) △H1= —393.5kJ·mol-1
2H2(g)+O2(g)===2H2O(g) △H2= —483.6kJ·mol-1
C(s)+H2O(g)===CO(g)+H2(g) △H3= +131.3kJ·mol-1
则反应CO(g)+H2(g)+O2(g)===H2O(g)+CO2(g)的△H=kJ·mol-1。
标准状况下的煤炭气(CO、H2)33.6L与氧气反应生成CO2和H2O,反应过程中转移______mol电子。
(2)熔融碳酸盐燃料电池(MCFS),是用煤气(CO+H2)作负极燃气,空气与CO2的混合气为正极助燃气,用一定比例的Li2CO3和Na2CO3低熔点混合物做电解质,以金属镍(燃料极)为催化剂制成的。负极的电极反应式为;
则该电池的正极反应式是。
(3)密闭容器中充有10 mol CO与20mol H2,在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。
CH3OH(g);CO的转化率(α)与温度、压强的关系如下图所示。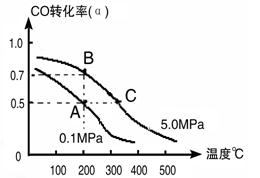
①若A、B两点表示在某时刻达到的平衡状态,此时在A点时容器的体积为10L,则该温度下的平衡常数K=;此时在B点时容器的体积VB10L(填“大于”、“小于”或“等于”)。
②若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间tAtC(填“大于”、“小于”或“等于”)。
③在不改变反应物用量情况下,为提高CO转化率可采取的措施是。
平达喜是一种常用抗酸药,其主要成分是由短周期元素组成的化合物X,式量为602。甲同学欲探究X的组成。
查阅资料:①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、碱式碳酸镁铝(或结晶水合物)。②Al3+在pH=5.0时沉淀完全; Mg2+在p H=8.8时开始沉淀,在pH=11.4时沉淀完全。
H=8.8时开始沉淀,在pH=11.4时沉淀完全。
实验过程:
I.向一定量的X粉末中加入45.0mL的2mol/L盐酸溶液中,恰好完全反应并收集到112mL(标准状况下)的A气体,A气体可使澄清石灰水变浑浊。
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰。
Ⅲ.向I中所得的溶液中滴加氨水,调 节pH至5~6,产生白色沉淀B,过滤。
节pH至5~6,产生白色沉淀B,过滤。
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解。
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C。沉淀物进行洗涤干燥后重1.74g,
(1)A的电子式是。
(2)由I可确定X中存在两种带负电荷的原子团及个数比
(3)由I判断X一定不含有的元素是。
(4)Ⅲ中生成B的离子方程式是。
(5)Ⅳ中B溶解的化学方程式是。
(6)沉淀C的化学式是。
(7)若X中n(B)∶n(C)=1∶3,则X的化学式是。
(I)多项选择题
化学与科学、技术、社会、环境密切相关,下列做法中正确的是__________。
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |
E.利用化学反应原理,设计和制造新的药物
(II)
浩瀚的海洋是一个巨大的资源宝库,蕴藏着丰饶的矿产,是宝贵的化学资源,下图是海水加工的示意图,根据下图回答问题。
(1)海水淡化工厂通常采用的制备淡水的方法有(写出两种)。
(2)下图是从浓缩海水中提取溴 的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
的流程图。写出下图中①②的化学式:①,②,吸收塔中发生的化学反应方程式为。
(3)制备金属镁是通过电解熔融的MgC12,而不用MgO,其原因是。
(4)食盐也是一种重要的化工原料,氯碱工业就是通过电解饱和食盐水来制备NaOH、H2和C12。海水中得到的粗盐中往往含有一些杂质,必须加入一些化学试剂,使杂质沉淀,处理后的盐水还需进入阳离子交换塔,其原因是。电解食盐水在离子交换膜电解槽中进行,离子交换膜的作用是。
(5)多晶硅主要采用SiHCl3还原工艺生产,其副产物SiCl4可转化为SiHCl3而循环使用。一定条件下,在20L恒容密闭容器中的反应:3 SiCl4(g)+2 H2(g)+Si(g) 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为kg。
质量为kg。
(I)多项选择题
下列说法中正确的是。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是,其中Ti4+的氧配位数为,Ba2+的氧配位数为,
(3)常温下的TiCl4是有刺激性臭味的无 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是化合物,其固体是晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有种同分异构体,请在下图方框中将其画出。
(I)多项选择题
下列合成路线中,涉及到的反应类型有_________。
| A.加成反应 | B.氧化反应 | C.还原反应 |
| D.加聚反应 E.缩聚反应 |
(II)
(1)A的含氧官能团的名称是。
(2)A在催化剂作用可与H2反应生成B,该反应的反应类型是。
(3)酯类化合物C的分子式是C15H14O3,其结构简式是。
(4)A发生银镜反应的化学方程式是。
(5)扁桃酸( )有多种同分异构体。属于甲酸酯且含酚羟基的同分异
)有多种同分异构体。属于甲酸酯且含酚羟基的同分异
构体有种,写出 其中一个含亚甲基(-CH2-)的同分异构体的结构简式
其中一个含亚甲基(-CH2-)的同分异构体的结构简式
______________。
(6)N在NaOH溶液中发生水解反应的化学方程式是。