在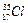 原子中含有 个质子, 个中子;它的原子结构示意图为 。铁在氯气中燃烧,生成 ,在这个反应中,氯气是 剂(填“氧化”,或“还原”)。
原子中含有 个质子, 个中子;它的原子结构示意图为 。铁在氯气中燃烧,生成 ,在这个反应中,氯气是 剂(填“氧化”,或“还原”)。
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、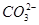 、
、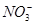 、
、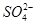 ,已知:
,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,一定没有的阳离子是;所含阴离子相同的两种盐的化学式是。
(2)D的化学式为,D溶液显碱性的原因是(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是;
E和氨水反应的离子方程式是。
(4)若要检验B中所含的阳离子,正确的实验方法是。
A、B、C、D四种可溶的化合物(所含离子各不相同),分别由阳离子Na+、Mg2+、Al3+、Ba2+和阴离子OH-、Cl-、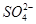 、
、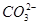 两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
两两组合而成。为了确定这四种化合物的成分,某同学进行了如下实验操作:
①将四种化合物各取适量配成溶液,分别装入四支试管。
②取A溶液分别滴入另外三种溶液中,记录实验现象如下:
B溶液白色沉淀沉淀不溶解
C溶液白色沉淀沉淀不溶解
D溶液白色沉淀沉淀部分溶解
③向B溶液中滴入D溶液,无明显实验现象。
请回答下列问题:
(1)写出它们的化学式:
A;B;C;D;
(2)上述②的第三次实验,再加入A,沉淀部分溶解的离子方程式。
(3)③中若向C溶液中滴入D溶液,可能出现的实验现象是。用离子方程式表示其原因:。
某无色溶液只可能含有以下几种离子:①Mg2+、②Al3+、③Fe2+、④H+、⑤ 、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
、⑥Cl-、⑦OH-。向其中缓慢地滴入NaOH溶液至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此可确定原溶液中一定含有的离子是
| A.①②⑤ | B.①③④ | C.②⑥⑦ | D.①②④⑥ |
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
(1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为
P4(s,白磷)+5O2(g)===P4O10(s) ΔH1=-2 983.2 kJ·mol-1
P(s,红磷)+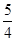 O2(g)===
O2(g)=== P4O10(s) ΔH2=-738.5 kJ·mol-1
P4O10(s) ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为。
(2)已知298 K时白磷不完全燃烧的热化学方程式为P4(s,白磷)+3O2(g)===P4O6(s) ΔH=-1638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气(标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为,反应过程中放出的热量为。
(3)已知白磷和PCl3的分子结构如图,现提供以下化学键的键能(kJ·mol-1):P—P 198,Cl—Cl 243,P—Cl 331。
则反应P4(s,白磷)+6Cl2(g)===4PCl3(s)的反应热ΔH=。
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) ===2Fe(s)+3CO(g) ΔH=-492.7 kJ·mol-1
②3CO(g)+Fe2O3(s) ===2Fe(s)+3CO2(g) ΔH=+25.2 kJ·mol-1
则2Fe2O3(s)+3C(s) ===4Fe(s)+3CO2(g) ΔH=kJ·mol-1。
(2)天然气(以甲烷计)在工业生产中用途广泛。甲烷蒸汽转化法制H2的主要转化反应如下:
CH4(g)+H2O(g) ===CO(g)+3H2(g) ΔH=+206.2 kJ·mol-1
CH4(g)+2H2O(g) ===CO2(g)+4H2(g) ΔH=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使氨合成催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时又可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是。