在CaCO3、CO2、CO、Na2CO3、NaHCO3、Cl2物质中(本题3分)
⑴大气中过多会造成温室效应的是_______________.
⑵俗名是小苏打,且是制糕点发酵粉的主要成分的是________
⑶能和血液中血红蛋白结合而使人中毒的是_________________
⑷是水垢的主要成分_______________
⑸能用于制造漂白粉的是__________________
⑹俗名是纯碱,工业上用于造纸业的是___________
(9分)原子序数依次增加的A、B、C、D、E、F六种常见元素中,A、B、C、D是短周期非金属元素,B、C、D同周期,E、F是第四周期的金属元素,F+的三个能层电子全充满。下表是主要化合价及原子半径数据:
| A |
B |
C |
D |
E |
F |
|
| 主要化合价 |
-1 |
-3 +5 |
-2 +6 |
-1 +7 |
+2 |
+1 +2 |
| 原子半径 |
0.071 |
0.11 |
0.102 |
0.099 |
0.197 |
0.117 |
(1)B、C、D三种元素第一电离能数值由小到大的顺序是(填元素符号);
(2)B的氢化物中心原子采取杂化,空间构型是形,是分子(填“极性”或“非极性”);
(3)F2+与NH3 形成配离子的结构式为;往某种蓝色溶液中加入氨水,形成蓝色沉淀,继续加入氨水,难溶物溶解变成蓝色透明溶液,可得到含有上述配离子的配合物。写出沉淀溶解的离子方程式。
(4)A 、E两种元素形成晶体晶胞是下图中的(填①、②、③或④);
①②③④
(5)如图四条折线分别表示ⅣA族、ⅤA族、ⅥA族、ⅦA族元素气态氢化物沸点变化,请选出C的氢化物所在的折线(填n、m、x或y)。
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,右下图为磷化硼晶体结构中最小的重复结构单元。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr。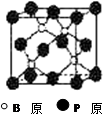
回答下列问题:
(1)上述反应物中含有一种元素,其基态原子具有八种不同能量电子,写出其基态原子的价电子轨道表示式 。
(2)BP中每个B或P原子均形成4个共价键,其中有一个配位键,提供空轨道是 原子。
(3)磷化硼的晶体类型是 ,B原子的杂化方式是 ,每生成1molBP,共形成 molB-P键。
(4)已知BBr3+PBr3+3H2=BP+6HBr反应中,P元素被还原,判断电负性:P B (填“>”、“<”)
(5)BBr3分子中,B原子采取 杂化,键角为
(6)氮化硼晶体的熔点要比磷化硼晶体高,其原因是
。
( 12分)有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请回答问题。
| A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能分别是: I1=738kJ/mol I2 =" 1451" kJ/mol I3 = 7733kJ/mol I4 = 10540kJ/mol |
| D原子核外所有p轨道全满或半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第八列 |
(1)已知BA5为离子化合物,是由、两种微粒构成的(填化学符号)。
(2)B基态原子中能量最高的电子,其电子云在空间有个方向,原子轨道呈形。
(3)某同学根据上述信息,推断C基态原子的核外电子排布为,
该同学所画的电子排布图违背了。
(4)G位于族,G3+价电子排布式为。GE3常温下为固体,熔点 ,沸点
,沸点 ,在
,在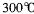 以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断GE3的晶体类型为________________。
(5)DE3 中心原子的杂化方式为,其空间构型为。
(6)前四周期中与F同一族的所有元素分别与E元素形成化合物,其晶体的熔点由高到低的排列顺序为(写化学式),原因是
( 9分)A、B都是短周期元素,原子最外层电子排布式分别为(n+1)sx、nsx+1npx+3。A与B可形成化合物D。D溶于水时有气体逸出,该气体能使带火星的木条复燃。请回答下列问题:
(1)比较电离能:I1(A)________I1(B)(填“>”或“<”,下同),比较电负性:A________B。
(2)通常A元素的化合价是________,对A元素呈现这种价态进行解释:
①用原子结构的观点进行解释: _______________________________________。
②用电离能的观点进行解释: ___________________________________________。
③写出D跟水反应的离子方程式:_______________________________________。
( 8分, 多选错选不得分)现有下列物质, 用编号填空回答下列问题:
A.干冰B.金刚石C. 氦D.过氧化钠E.二氧化硅F. 溴化铵
(1)通过非极性键形成的原子晶体是:。
(2)可由原子直接构成的晶体是: 。
(3)含有离子键、共价键、配位键的化合物是:。
(4)含有非极性键的离子化合物是:。
(5) 已知微粒间的作用力包括离子键、共价键、金属键、范德华力、氢键。氯化钠熔化,粒子间克服的作用力为____________;二氧化硅熔化,粒子间克服的作用力为____________;干冰气化,粒子间克服的作用力为____________。A、B、C、D四种物质的熔点从低到高的顺序为____________________(填序号)。