低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
| 时 间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
 3 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
| t1℃时物质浓度(mol/L)的变化 |
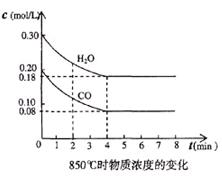
(3) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
| A.增加水蒸气 | B.降低温度 | C.使用催化剂 | D.增加氢气浓度 |
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为: 。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为 。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
。
根据下图所示,推断物质X的化学式。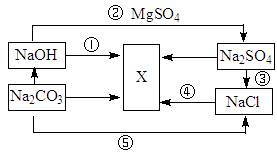
X的化学式
某混合物由NaCl、MgCl2两种物质组成,其中Na和Mg两种元素的质量比为23∶12。求
⑴NaCl与MgCl2的物质的量之比。
⑵氯离子总量为8mol时,Mg2+的物质的量是 。
。
8.4g N2与9.6g某单质Rx,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是,x值为。
同温同压下,某瓶充满氧气时质量为116g,充满二氧化碳时,质量为122g,充满气体A时质量为114g,A的摩尔质量为________。