写出铁和水蒸气反应的化学方程式,用单线桥标出电子转移的方向和数目。
能源问题是人类社会面临的重大课题,甲醇是未来重要的能源物质之一。
(1)合成甲醇的反应为:CO(g)+2H2(g)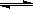 CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H0。(填“>、<或=”下同)
CH3OH(g);下图表示某次合成实验过程中甲醇的体积分数φ(CH3OH)与反应温度的关系曲线,则该反应的△H0。(填“>、<或=”下同)
(2)在某温度下,向一个容积不变的密闭容器中通入2.5mol CO和7.5mol H2,达到平衡时CO的转化率为90%,此时容器内的压强为开始时的倍。
(3)利用甲醇燃料电池设计如图所示的装置:
①则该装置中b为极,写出装置中电解池内发生反应的离子方程式,
②当锌片的质量 变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为L。
变化为12.8 g时,a极上消耗的O2 在标准状况下的体积为L。
(4)低碳经济是以低能耗、低污染、低排放为基础的经济模式,其中一种技术是将CO2转化成有机物实现碳循环。如:
2CO2(g)+2H2O(l)="=" C2H4(g)+3O2(g) ΔH=+1411.0 kJ/mol
2CO2(g)+3H2O(l)="=" C2H5OH(1)+3O2(g) ΔH=+1366.8 kJ/mol
则由乙烯水化制乙醇反应的热化学方程式。
物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)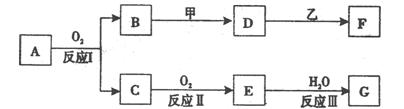
回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。则:①反应Ⅲ的化学方程式为___________________________________。
②D与乙反应的离子方程式为____________________________________
(2)第二种情况:甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。则:
①工业上,反应 I的化学方程式为______________________________________
生产设备名称为:
②D和乙反应的离子方程式为____________________________________
③请简述检验D溶液中阳离子的方法。
④若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=(列出计算式即可)。
A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置,
在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:。
(2)D、F的气态氢化物,沸点较高的是(填分子式)。
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH7(填“>”“<”或“=”),原因是。
从樟科植物枝叶提取的精油中含有下列甲、乙、丙三种成分:
(1)甲中含氧官能团的名称为。
(2)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
其中反应Ⅰ的反应类型为,反应Ⅱ的化学方程式为(注明反应条件)。
(3)已知: 由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质
由乙制丙的一种合成路线图如下(A~F均为有机物,图中Mr表示相对分子质 量):
量):
①下列物质不能与C反应的是(选填序号)
a.金属钠 b.HBrc. 溶液 d.乙酸
溶液 d.乙酸
②写出F的结构简式。
③D有多种同分异构体,任写其中一种能同时满足下列条件的异构体结构简式。
a.苯环上连接着三种不同官能团 b.能发生银镜反应
c.能与 发生加成反应 d.遇
发生加成反应 d.遇 溶液显示特征颜色
溶液显示特征颜色
④综上分析,丙的 结构简式为。
结构简式为。
(1)工业上以粗铜为原料采取如图所示流程制备硝酸铜晶体:
①在步骤a中,还需要通入氧气和水,其目的是。
②在保温去铁的过程中,为使Fe3+沉淀完全,可以向溶液中加入CuO,调节溶液的pH,根据下表数据,溶液的pH应保持在范围。
| 氢氧化物开始沉淀时的pH |
氢氧化物沉淀完全时的pH |
|
| Fe3+ Cu2+ |
1.9 4.7 |
3.2 6.7 |
不用加水的方法调节溶液pH的 原因是。
原因是。
③进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)。
(2)工业上常利用硝酸铜溶液电镀铜,电镀时阴极的电极反应式是。
(3)图-2是某小组同学 查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度
查阅资料所绘出的硝酸铜晶体[ Cu(NO3)2·nH2O ]的溶解度曲线(温度 在30℃前后对应不同的晶体),下列说法正确的是(填字母)。
在30℃前后对应不同的晶体),下列说法正确的是(填字母)。
a. A点时的溶液为不饱和溶液
b. B点时两种晶体可以共存
c. 按上述流程最终得到的晶体是Cu(NO3)2·3H2O
d. 若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2·6H2O晶体