肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在25℃,101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ
(1)写出该状态下N2H4完全燃烧反应的热化学方程式
。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是
。
( 3)下图是一个电化学过程示意图。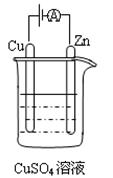
①锌片上发生的电极反应式是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上需要标准状况下的空气
L(假设空气中氧气体积含量为20%)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)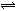 CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),右下图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。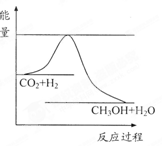
(1)关于该反应的下列说法中,正确的是。
A.△H>0,△S>0; B.△H>0,△S<0;
C.△H<0,△S<0; D.△H<0,△S>0。
(2)该反应平衡常数K的表达式为。
(3)温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
(4)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时问变化如下图所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)___:mol·L-1·min-1。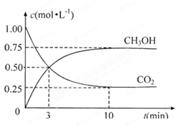
(5)下列措施中能使(4)中n(CH3OH)/n(CO2)增大的有。
A.升高温度;
B.加入催化剂;
C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2;
E.充入He(g),使体系总压强增大。
常温下,有四种溶液:
| ① |
② |
③ |
④ |
⑤ |
| 0.001mol·L-1 CH3COOH溶液 |
pH=10 NaOH溶液 |
0.001mol·L-1 NaOH溶液 |
pH=4 CH3COOH溶液 |
pH=4 NH4Cl溶液 |
回答下列问题:
(1)①稀释到原来的10倍后的溶液pH④溶液的pH。 (填“>”或“=”或“<”等,下同)。
(2)④和⑤两溶液中水电离出的c(H+):④⑤。
(3)①与③混合,若溶液pH=7,则两溶液体积关系为V(NaOH) ______V(CH3COOH)。
(4)②与④等体积混合,则溶液pH7,其所得溶液中的溶质组成可能为:。
用实验确定某酸HB的弱电解质。两同学的方案是:
甲:①称取一定质量的HB配制0.1mol/L的溶液100mL;
②用pH试纸测出该溶液的pH值,即可证明HB是弱电解质。
乙:①用已知物质的量浓度的HB溶液、盐酸,分别配制pH = 1的两种酸溶液各100mL;
②分别取这两种溶液各10mL,加水稀释为100mL;
③各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明HB是弱电解质。
(1)在两个方案的第①步中,都要用到的定量仪器是
(2)甲方案中,说明HB是弱电解质的理由是测得溶液的pH1(选填>、<、=)
乙方案中,说明HB是弱电解质的现象是(多选扣分)
A.HCl溶液的试管中放出H2的速率快;
B.装HB溶液的试管中放出H2的速率快;
C.两个试管中产生气体速率一样快。
(3)请你评价:乙方案中两个难以实现之处
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表达。
有机化合物A~E的转化如下列反应框图所示, 1 mol A和2 mol H2在一定条件下恰好反应,生成饱和一元醇X,X中碳元素的质量分数约为65%。 (1)X的分子式为。
(1)X的分子式为。
(2) A分子中所含官能团的名称是。
(3)上述转化①~④步反应中,属于取代反应类型的是(填序号)。
(4)C的结构简式为。
(5) D→E的反应方程式为。
F是新型降压药替米沙坦的中间体,可由下列路线合成: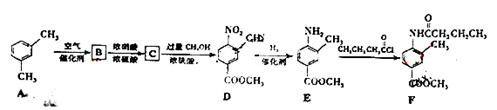
(1)A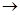 B的反应类型是,D
B的反应类型是,D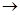 E的反应类型是,E
E的反应类型是,E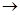 F的反应类型是。
F的反应类型是。
(2)写出满足下列条件的B的所有同分异构体(写结构简式)。
①含有苯环②含有酯基③能与新制Cu(OH)2反应
(3)C中含氧官能团名称是。已知固体C在加热条件下可溶于甲醇,下列C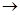 D的有关说法正确的是。
D的有关说法正确的是。
a.使用过量的甲醇,是为了提高D的产量 b.浓硫酸的吸水性可能会导致溶液变黑
c.甲醇即是反应物,又是溶剂 d.D的化学式为C9H9NO4