能源是人类生存和发展的重要支柱。研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义。已知下列热化学方程式:
① 2H2(g)+O2(g)=2H2O(l) ; H=-570 kJ·mol-1;
H=-570 kJ·mol-1;
② H2(g)+1/2O2(g)=H2O(g) ; H="-242" kJ·mol-1
H="-242" kJ·mol-1
③ C(s)+1/2O2(g)="CO(g) " ; H= —110.5 kJ·mol-1
H= —110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) ;  H=-393.5 kJ·mol-1
H=-393.5 kJ·mol-1
⑤ CO2(g) +2H2O(g)=2CH4(g) +2 O2(g) ; H= +890 kJ·mol-1
H= +890 kJ·mol-1
回答下列问题:
(1)上述反应中属于吸热反应的是
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然难直接测定,但可通过间接的方法求得。已知C(s) + H2O(g)= H2(g)+ CO (g)  H="a" kJ·mol-1;则a= ;该反应的熵
H="a" kJ·mol-1;则a= ;该反应的熵 S 0(选填“>”、“=”、“<”)。
S 0(选填“>”、“=”、“<”)。
碘缺乏症遍及全球,多发生于山区。南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高。据估计我国患者大约有1 000万人。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐中添加碘酸钾(KIO3)。
据此回答下列问题:
(1)碘是合成下列哪种激素的主要原料之一()
A.胰岛素 B.甲状腺激素
C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患()
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为___________,氧化产物与还原产物的物质的量之比为_____________,能观察到的明显现象是__________。
漂白粉在生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
(1)1998年,我国长江流域和松花江流域都发生了百年不遇的特大洪水。灾区人们的饮用水,必须用漂白粉等药品消毒后才能饮用,以防传染病发生,但瓶装漂白粉久置空气中会失效。试用化学方程式表示漂白粉在空气中易失效的原因:①;②。
(2)已知浓盐酸和次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)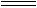 CaCl2+2Cl2↑+2H2O
CaCl2+2Cl2↑+2H2O
用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是()
①CO2②HCl③H2O④O2
A.①②③B.②③④C.②③D.①④
(3)用Cl2和石灰乳制作漂白粉的目的是()
A.转变为较HClO稳定且易储运的物质
B.转变为更易溶于水的物质
C.提高氯气的利用率
D.增强漂白能力
把一装满氯气的试管倒立在滴有酚酞溶液的NaOH溶液中,摇动试管。请描述现象并解释原因。
现象:
(1)。
(2)。
原因:
(1)。
(2)。
已知CN- (氰根离子)、SCN- (硫氰酸根离子)和Cl-有相似之处:两个CN原子团或两个SCN原子团可分别构成氰分子(CN)2和硫氰分子(SCN)2。(CN)2和(SCN)2的性质与Cl2的性质有相似之处,且常温、常压下是气体。写出下列反应的化学方程式:
(1)MnO2和HSCN溶液加热反应___________________________________。
(2)(CN)2和KOH溶液反应________________________________________。
(3)(SCN)2和AgNO3溶液反应______________________________________。
已知A、B、C、D四种物质的关系如下:
①A+KOH(浓溶液)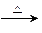 B+C+H2O;
B+C+H2O;
②C B+D;
B+D;
③C+HCl(浓) A+B+H2O。A、D是单质,常温下都是气体,由此可推断出A、B、C、D(写化学式)为:A_____________.,B______________.,C_______________.,D._________。写出①的化学方程式,并标明电子转移的方向和数目:__________________。
A+B+H2O。A、D是单质,常温下都是气体,由此可推断出A、B、C、D(写化学式)为:A_____________.,B______________.,C_______________.,D._________。写出①的化学方程式,并标明电子转移的方向和数目:__________________。