(4分)已知:CH2=CH-CH=CH2和Br2按物质的量之比1:1发生加成反应时,可得到两种产物:CH2BrCHBrCH=CH2与CH2BrCH=CHCH2Br,
则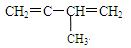
①和Br2 按物质的量之比1:1发生加成反应时,可得到 种产物
②和HBr按物质的量之比1:1发生加成反应时,可得到 种产物。
有下列物质:①铜;②硫酸钡固体;③氢氧化钠固体;④氨水;⑤熔融硝酸钾;⑥乙醇;⑦液态HCl;⑧石墨;⑨二氧化硫;⑩冰醋酸; ⑾硫。
(1)其中能导 电的有________,其水溶液能导电的是________。
电的有________,其水溶液能导电的是________。
(2)属于非电解质的有________,属于强电解质的是________。
氢氧化铁胶体是中学中最重要的胶体,根据有关知识填空:
(1)实验室制备氢氧化铁胶体的方法是:取25mL蒸馏水,将其,向其中逐滴加入1~2mL,继续煮沸至,停止加热。
(2)将制备好的氢氧化铁胶体装入电泳装置,接通直流电,一段时间之后, ___极颜色加深。(填:“阴”或“阳”)
(3)向制备好的氢氧化铁胶体中逐滴加入硫酸能看到什么现象________(填序号)
A、生成大量沉淀 B、先沉淀再溶解 C、溶液澄清透明
用离子方程式表达下列应用或现象
(1)水垢的主要成分是碳酸钙和氢氧化镁,家庭中可用一定浓度的醋酸( CH3COOH)将其浸泡除去(任写一个即可)。
(2)向澄清石灰水中通二氧化碳气体变浑浊。
(3)小苏打治疗胃酸过多。
(4)向NaHSO4溶液中加入锌粉 。
。
测我国了“神舟”系列载人飞船的成功发射,标志着“炎黄子孙千年飞天梦想实现了”
(1)火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高,在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是_____(填写编号)。
| A.在高温下不融化 | B.在高温下可分解气化 |
| C.在常温下就分解气化 | D.该涂料不可能发生分解 |
(2)火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2O4 + N2H4 → N2 + H2O 。请配平该反应方程式:
+ H2O 。请配平该反应方程式:
————N2O4 + ————N2H4 → ————N2 + ————H2O
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是 。
(3)为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。
①写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似): ___________________;_________________________。
②你选择的供氧剂是:_______________。
(6分)在有机溶剂里,使 与
与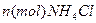 发生完全反应,释放出
发生完全反应,释放出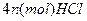 ,同时得到一种白色晶体A,A的熔点为113℃,在减压
,同时得到一种白色晶体A,A的熔点为113℃,在减压 时,50℃即可升华,测得A蒸气的密度(标准状况)为
时,50℃即可升华,测得A蒸气的密度(标准状况)为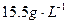 。
。
(1)通过计算得出A的化学式___________。
(2)生成A晶体的化学方程式为_____________。
(3)分子结构测定结果表明,同种元素的原子在A分子中所处的环境毫无差别,试写出A的结构式:____________。