煤经过化学加工可转化为气体或液体燃料以及各种化工产品,从而提高了煤的利用率。
(1)将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g)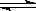 CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1
①下列措施中,不能提高碳的转化率的是 (填字母序号)。
a.容器的容积不变,增加水蒸汽的物质的量
b.缩小容器的容积,增大压强
c.及时将水煤气从容器中移走
d.其他条件不变,升高温度
②又知,C(s)+CO2(g)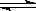 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1
则CO(g)+H2O(g)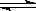 CO2(g)+H2(g)的焓变(△H)为 。
CO2(g)+H2(g)的焓变(△H)为 。
(2)CO与H2在一定条件下可反应生成甲醇,CO(g)+2H2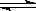 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。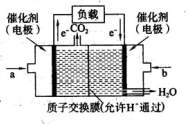 ①a处通入的是 (填物质名称),左侧电极上发
①a处通入的是 (填物质名称),左侧电极上发
生 (填“氧化”或“还原”)反应。
②该电池工作过程中,H+的移动方向为从 到
(填“左”或“右”)
③该电池正极反应式为 。
④若用该电池提供的电能电解60mL NaCl溶液,设有
0.01molCH3OH完全放电,NaCl足量,且电解产生的
Cl2全部溢出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH= 。
(3)将等量的CO(g)和H2O(g)分别通入到容积为2L的恒容密闭容器中进行如下反应,
CO(g)+H2O(g) CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据: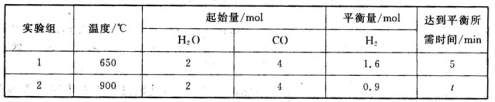
①在实验1中,以v(CO2)表示该反应的反应速率为 mol·L-1·min-1;
②在实验2中,t 5。(填“>”、“<”或“=”)
将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol∙L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示。
(1)写出OA段所发生反应的离子方程式:___________________。
(2)当加入35mL盐酸时,产生的CO2在标准状况下的体积为___________mL。
(3)原混合物中的Na2CO3和NaHCO3的物质的量之比为_________。
(4)NaHCO3固体受热分解的化学方程式为____________________。
在某澄清溶液中,可能存在下列几种离子:H+、K+、Ba2+、SO42-、I-、CO32-。取该溶液进行下列实验:①用pH试纸检验,该溶液呈强酸性;②取200mL溶液加入少量氯水和少量CCl4,振荡后静置,CCl4层呈紫色;③另取部分溶液逐滴加入NaOH溶液,当溶液呈碱性时,再加入Na2CO3溶液,有白色沉淀生成。
(1)根据上述实验现象,推断原溶液中肯定存在的离子是_____________,肯定不存在的离子是_______,可能存在的离子是____________。
(2)若步骤②中消耗0.1molCl2,则溶液中与Cl2反应的离子的物质的量浓度为________________。
(3)写出实验③中生成白色沉淀的离子方程式:__________________________。
明胶是水溶性蛋白质混合物,溶于水会形成胶体。工业明胶制成的胶囊中往往含有超标的重金属Cr,因而对人体造成伤害。
(1)用一束光照射明胶水溶液,可观察到_________现象。
(2)Na2CrO4是工业中常用的氧化剂,工业上可用FeCr2O4(Cr元素的化合价为+3)制Na2CrO4,其反应为4FeCr2O4+8Na2CO3+7O2==8Na2CrO4+2Fe2O3+8CO2。
①FeCr2O4中铁元素的化合价为_______,用氧化物的形式表示FeCr2O4的化学式:________。
②该反应的氧化产物是________;每生成1mol Na2CrO4时,转移电子_____mol。
已知Si与NaOH溶液反应的化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑。
(1)将等物质的量的下列物质投入到足量的烧碱溶液中,完全反应放出气体最多的是()
| A.硅 | B.铝 | C.钠 | D.铁 |
(2)将9.2 g钠和4.2 g硅同时投入到过量冷水中,充分反应后,在标准状况下,能生成氢气的体积是 L。
(1)AlCl3溶液与NaOH溶液反应时,当Al3+的物质的量与OH-的物质的量之比(以下均填物质的量之比)为________时,Al(OH)3沉淀量最多。
(2)NaAlO2溶液与盐酸溶液反应时,AlO的物质的量与H+的物质的量之比为________时,Al(OH)3沉淀恰好溶解。