物质的量浓度都为0.1mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
| A.[Na+]+[H+]=[OH-]+[CH3COO-] |
| B.[Na+]>[CH3COO-]>[H+]>[OH-] |
| C.[OH-]=[H+]+[CH3COOH] |
| D.[CH3COOH]+[CH3COO-]=[Na+] |
(12分)Ⅰ.某反应中反应物与生成物有: AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物单质X。
(1)写出反应的化学方程式:__________________________________________________。
(2)根据上述反应可推知________。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
Ⅱ.常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、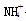 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-,已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。请回答:
(3)所含阴离子相同的两种盐的化学式是________________________________。
(4)A的化学式为________,D溶液显碱性的原因是(用离子方程式表示): ______________________。
(5)若要检验B中所含的阳离子,正确的实验方法是_________________________________________。
(14分)CH4和CO2反应可以制造价值更高的化学产品。
(1)250℃时,以镍合金为催化剂,向4 L容器中通入6 mol CO2、6 mol CH4,发生反应:CO2 (g)+CH4(g) 2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
2CO(g)+2H2(g)。达到平衡时CH4的物质的量为2mol。
①此温度下,该反应的平衡常数K=________(注明单位)。
②保持温度不变,改变CH4和CO2的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是(填序号)。
a.容器内气体平均相对分子质量不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗2a mol H2
d.混合气中n(CH4)∶n(CO2)∶n(CO)∶n(H2) =1∶1∶4∶4
③已知:a.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H1kJ·mol-1
b.CO(g)+H2O (g)=CO2(g)+H2 (g) △H2kJ·mol-1
c.2CO(g)+O2(g)=2CO2(g) △H3kJ·mol-1
反应CO2(g)+CH4(g) 2CO(g)+2H2(g)的△H="__" kJ·mol-1
2CO(g)+2H2(g)的△H="__" kJ·mol-1
(2)用Cu2Al2O4做催化剂,一定条件下,发生反应:
CO2+CH4 CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。
CH3COOH,温度与催化剂的催化效率和乙酸的生成速率如图。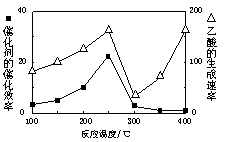
250~300℃时,温度升高而乙酸的生成速率降低的原因是_________________________ __________。
(3)Li2O、Na2O、MgO均能吸收CO2,
①若寻找吸收CO2的其他物质,下列建议合理的是_________。
A.可在碱性氧化物中寻找
B. 可在具有强氧化性的物质中寻找
C.在ⅠA、ⅡA族元素的氧化物中寻找
②Li4SiO4可用于吸收、释放CO2, 原理是: 500℃时,CO2与Li4SiO4接触生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2,Li4SiO4再生,该原理的化学方程式___________ ____________________________________。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,有关电极反应可表示为______________________。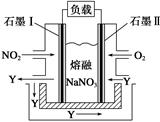
(15分)由香兰素制取多巴胺的,合成过程如下: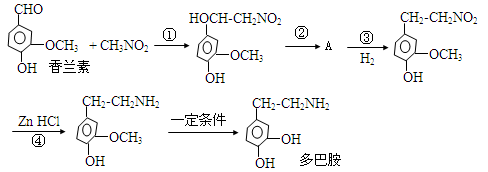
请回答下列问题:
(1)香兰素除了醛基之外,还含有官能团的名称是。
(2)多巴胺的分子式是。
(3)上述合成过程中属于加成反应类型的是:(填反应序号)。
(4)写出符合下列条件的多巴胺的其中一种同分异构体的结构简式:
①属于1,3,5-三取代苯;②苯环上直接连有一个羟基和一个氨基;③分别能与钠和氢氧化钠反应,消耗钠与氢氧化钠的物质的量之比为2∶1。_________________________
(5)请写出有机物A与足量浓溴水反应的化学方程式。
___________________________________________________________________________
(14分)某课外活动兴趣小组欲用下列化学试剂在实验室里制取Cl2并验证Cl2的某些化学性质。实验试剂:3 mol·L-1 H2SO4、1 mol·L-1 NaOH溶液、MnO2、KMnO4、吸收少量SO2的NaOH溶液、浓盐酸、紫色石蕊试液、饱和NaCl溶液、BaCl2溶液、品红溶液。甲小组设计的实验装置如下图,B中盛装的是吸收少量SO2的NaOH溶液,D中盛装的是1 mol·L-1 NaOH溶液。请回答下列问题: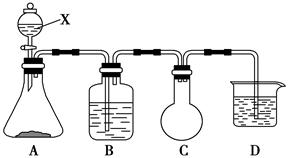
Ⅰ.
(1)写出仪器X的名称:________。
(2)写出A中发生反应的化学方程式:__________________________________。
(3)C装置的作用是_________________________________________________。
(4)D装置中反应的离子方程式:__________________________________。
(5)甲小组通过该实验要验证Cl2的________(填“漂白性”、“还原性”或“氧化性”);乙小组认为甲小组设计的实验装置有缺陷,请你帮助甲小组完善该装置。即还要A和B装置间连接一个装有_____________的洗气装置。
Ⅱ.丙小组认为反应一段时间后,B装置溶液(强碱性)中肯定存在Cl-、OH-和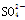 ,可能还含有其他的阴离子。请你帮助丙小组分析该吸收液中其他阴离子能否同时存在________(填“能”或“否”)。
,可能还含有其他的阴离子。请你帮助丙小组分析该吸收液中其他阴离子能否同时存在________(填“能”或“否”)。
高氯酸铵可用于火箭推进剂,实验室可由NaClO3等原料制取(部分物质溶解度如右图),其实验流程如下: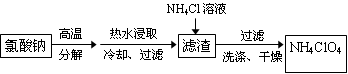
(1)氯酸钠受热分解生成高氯酸钠和氯化钠的化学方程式为。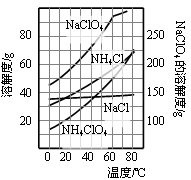
(2)滤渣的主要成分是(填化学式)。
(3)滤渣中加入氯化铵饱和溶液发生反应的离子方程式为。
(4)已知:2NH4ClO4 N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
N2↑+2O2↑+Cl2↑+4H2O,现可提供下列试剂:
a.饱和食盐水b.浓H2SO4c.NaOH溶液d.Mge.Fef.Cu
利用下图装置(夹持装置略)对高氯酸铵热分解产生的三种气体进行分步吸收或收集。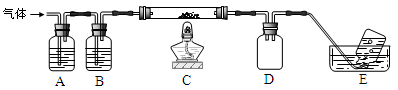
①E中收集到的气体可能是(填化学式) 。
②A、B、C中盛放的药品依次可以是、、(填字母序号)。