某混合物X由A12O3、Fe2O3、Cu、SiO2中的一种或几种物质组成。进行如下实验。
请回答:
(1)由I可知X中一定存在的是 ,步骤I所发生反应的离子方程式为: 、 。
(2)反应II的化学方程式是 。
为进一步确定上述混合物X的成分,另取9.4gX进行如下实验。
(3)由Ⅲ可得出的结论为: 。
(4)步骤Ⅳ所得蓝色溶液中阳离子为 。
(5)原混合物中各成分的质量之比是 。(不必化简)
溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。实验室制取溴乙烷的反应如下:
NaBr+H2SO4(浓) NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
已知反应物的用量:①NaBr(s) 0.3 mol,②浓硫酸36 mL(98%、密度1.84 g•cm–3),
③乙醇0.25 mol,④水25 mL,其中乙醇的密度为水的密度的4/5。
试回答:
(1)仅用如下图所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器(相关胶塞上已打合适的孔,胶管未画出。)的选择和连接顺序为(填数字)。
(2)在实验过程中,考虑到浓硫酸性质的特殊性,试剂加入的合理顺序为________________(请填写试剂的编号);
(3)若试剂加入过快,可看到烧瓶内有红棕色气体产生,写出反应的化学方程式:
。
(4)判定有溴乙烷生成的现象是__________________________。从棕黄色的粗溴乙烷制取无色的溴乙烷,第一步可以加入蒸馏水或NaHSO3溶液,本操作中通常使用的仪器是__________。
(5)本实验的产率为60%,则可制取溴乙烷g。
含苯酚的工业废水处理的流程图如下: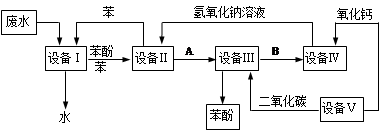
(1) 上述流程里,设备Ⅰ中进行的是_______________操作(填写操作名称)。
(2) 由设备Ⅱ进入设备Ⅲ的物质A是________。由设备Ⅲ进入设备Ⅳ的物质B是________。
(3) 在设备Ⅲ中发生反应的化学方程式为_________________________________________。
(4) 在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、H2O和_________,通过操作_________ (填写操作名称)可以使产物相互分离。
(5)上图中能循环使用的物质是C6H6、CaO、___________、___________。
某研究性学习小组对双氧水开展如下研究。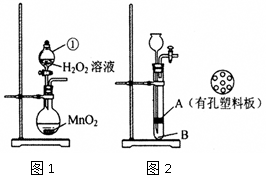
(1)图1中仪器①的名称,该装置中发生的化学方程式为
。图1装置也可以用于实验室制气体(只填一种即可)
(2)小杨同学将MnO2与水泥按一定比例加水混合、凝固,制作成小块状固体,加入图2装置中制氧气,以方便实验结束回收二氧化锰。实验前检查该装置气密性的方法是:
打开旋塞,从长颈漏斗口注水至,关闭旋塞,继续注水,使漏斗中液面略高于试管中液面,一段时间后,高度差不变,说明气密性良好。其中块状固体应放置在处(填“A”或“B”)
(3)利用图2装置反应一段时间后,需停止反应,其操作是。
(4)Cu与稀硫酸不能直接反应,但滴加H2O2溶液并加热,能生成水和一种蓝色溶液。则该反应的化学方程式为。
欲用质量分数为98%的浓硫酸(ρ=1.84g/cm3)配制浓度为0.5mol/L的稀硫酸500mL。
简要回答下列问题:
(1)量取所需浓硫酸的体积为_____________mL。
(2)如果实验室有15 mL、 20mL、 50mL的量筒,应选用_________mL的量筒最好,量取时发现量筒不干净,用水洗净后直接量取,使结果浓度_______(填“偏高”“偏低”“无影响”)
(3)下面是某学生的操作过程:
a.检查容量瓶是否漏水;
b.用(2)中选择的量筒量取浓硫酸;
c.将浓硫酸倒入另一个盛有适量蒸馏水的量筒中稀释,并冷却到室温;
d.用玻璃棒引流,将稀释后的硫酸倒入500 mL的容量瓶;
e.轻轻摇动容量瓶,使瓶内液体混合均匀,再向容量瓶中加水至离刻度线1 cm~2 cm;
f.用胶头滴管加水至凹液面底部与刻度线相切,摇匀;
g.在容量瓶上贴上标签待用。
按照通常的配制要求,指出其中缺少或操作的错误,并补充或改正(有几项填几项,若空格不够可以补加)。
①________________________________________________________;
②________________________________________________________;
③________________________________________________________;
④________________________________________________________;
⑤_________________________________________________________。
如图所示a、b、c、d分别是几种常见漏斗的上部,A、B、C、D是实际操作中各漏斗的下部插入容器中的示意图,请指出A、B、C、D分别与a、b、c、d相匹配的组合及其组合后装置在实验中的应用,例如:C和a组合,用于制取气体。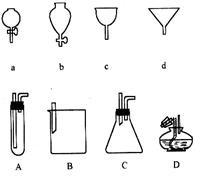
① A与组合,用于,
② B与组合,用于,
③ B与组合,用于,
④ D与组合,用于,