物质A ~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。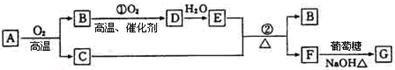
请回答下列问题:
(1)写出下列物质的化学式:B 、E 、G ;
(2)利用电解可提纯C物质,在该电解反应中阳极物质是 ,阴极物质是 ,电解质溶液是 ;
(3)反应②的化学方程式是 ;
(4)将0.23molB和0.11mol氧气放入容积为1L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12molD,则反应的平衡常数K= 。若温度不变,再加入0.50mol氧气后重新达到平衡,则B的平衡浓度 (填“增大”、 “不变”或“减小”),氧气的转化率 (填“升高”、“不变”或“降低”),D的体积分数 (填“增大”、“不变”或“减小”)。
铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:

①该反应的平衡常数表达式为:
②该温度下,在2 盛有 粉末的密闭容器中通入 气体,10后,生成了单质铁11.2 。则10 内 的平均反应速率为
(2)请用上述反应中某种气体的有关物理量来说明该反应已达到平衡状态: ①②
①② (3)某些金属氧化物粉末和
粉在镁条的引燃下可以发生铝热反应。下列反应速率(
)和温度(
)的关系示意图中与铝热反应最接近的是。
(3)某些金属氧化物粉末和
粉在镁条的引燃下可以发生铝热反应。下列反应速率(
)和温度(
)的关系示意图中与铝热反应最接近的是。

 (4)写出氢氧化铝在水中发生酸式电离的电离方程式:
(4)写出氢氧化铝在水中发生酸式电离的电离方程式: 欲使上述体系中
浓度增加,可加入的物质是。
欲使上述体系中
浓度增加,可加入的物质是。
环氧氯丙烷是制备树脂的主要原料,工业上有不同的合成路线,以下是其中的两条(有些反应未注明条件)。



完成下列填空: (1)写出反应类型:反应①反应③
(1)写出反应类型:反应①反应③
 (2)写出结构简式:
(2)写出结构简式:
 (3)写出反应②的化学方程式:
(3)写出反应②的化学方程式:
 (4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含
(4)与环氧氯丙烷互为同分异构体,且属于醇类的物质(不含 及
及 结构)有种。
结构)有种。
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,C为液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质),H溶液具有强氧化性、强酸性。现用A与石墨作电极,B的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)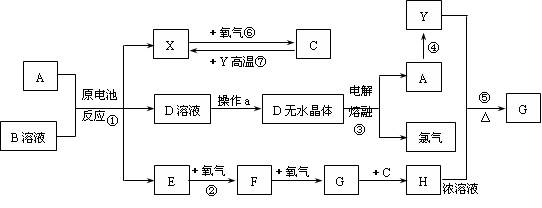
请填写下列空白:
(1)反应④为A在二氧化碳中燃烧,生成黑色固体单质Y和A的氧化物,其反应方程式为
。
(2)从D溶液制备D的无水晶体的“操作a”为。
(3)反应②的化学方程式为 。
(4)反应⑤的化学方程式为 。
(5)原电池反应①中正极的电极反应式为。
(6)A在元素周期表中有位置是:第_________周期、第__________族。
(7)Y的同素异形体有__________、___________、____________等。
在密闭容器中,发生反应H2 (g)+ I2 (g)  2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
2HI(g),通入xmol H2和ymol I2 蒸气,在下列条件下发生反应达到平衡,改变下列条件,正、逆反应速率会发生什么变化(增加、减小、不变)?分别填在横线上。
(1).升高温度,v正v逆
(2).加入催化剂, v正v逆
(3).充入更多的H2 , v正v逆
(4).取出一定量的I2 , v正v逆 (5).增大容器的体积, v正v逆
(5).增大容器的体积, v正v逆
(6).容器的体积不变,通入氖气, v正v逆
己知NO2与NaOH溶液的反应为3NO2+2NaOH=2NaNO3+NO+H2O,而NO、NO2与NaOH溶液的反应为NO2+NO+2NaOH=2NaNO2+H2O,欲用VL某烧碱溶液将含有nmolNO和mmolNO2的混合气全部吸收,则该烧碱溶液的物质的量浓度至少为________。