食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为_______ __(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为_____ ____。
(2)用提纯的NaCl配制500 mL4.00 mol·L-1NaCl溶液,所用仪 器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。
器除天平、药匙、玻璃棒外还有___ _____(填仪器名称)。
(3) 电解饱和食盐水的装置如图所示,
若收集的H2为2 L,
则同样条件下收集的Cl2______(填“>”、“=”或“<”)2 L,原因是__________。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是_____________。
(4)实验室制备H2和Cl2通常采用下列反应:Zn+H2SO4 ZnSO4+H2↑;MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
MnCl2+Cl2↑+2H2O,据此,从下列所给仪器装置中选择制备并收集H2的装置_______(填代号)和制备并收集干燥、纯净Cl2的装置_________(填代号)。
可选用制备气体的装置:
含苯酚的工业废水的方案如下图所示: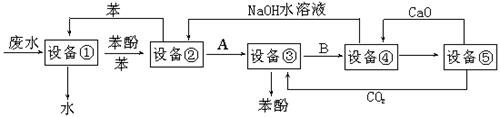
回答下列问题:
(1)设备①进行的是操作(填写操作名称),实验室这一步操作所用的仪器是。
(2)由设备②进入设备③的物质A是。
(3)在设备③中发生反应的化学方程式为。
(4)在设备④中,物质B的水溶液和CaO反应,产物是CaCO3、和水,再通过过滤得产物。
(5)上图中,能循环使用的物质是C6H6、CaO、NaOH水溶液、。
(6)写出同时满足下列条件的苯酚的一种同分异构体的结构简式是。
①核磁共振氢谱只有一个峰
②分子中无碳碳双键
某化学课外小组用下图装置制取纯净的溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭)。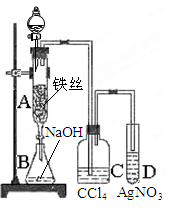
(1)写出A中反应的化学方程式。
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是,写出有关的化学方程式。
(3)C中盛放CCl4的作用是。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,现象是。
I下列实验操作或对实验事实的描述中正确的是_______________
①石油的分馏实验必须将温度计的水银球插入反应液中,测定反应液的温度,其中冷凝管起到冷凝回流的作用
②将0.1mol•L﹣1的NaOH溶液与0.5mol•L﹣1的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基
③不慎将苯酚溶液沾到皮肤上,立即用酒精清洗
④配制银氨溶液:在一定量AgNO3溶液中滴加过量氨水即可
⑤分离苯和苯酚的混合液,加入少量浓溴水,过滤
⑥将10滴溴乙烷加入1mL10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子.
II某校学生为探究苯与溴发生反应的原理,用如图装置进行实验.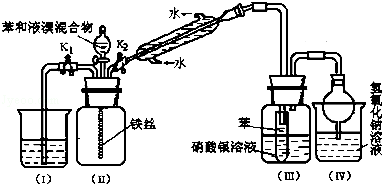
根据相关知识回答下列问题:
(1)实验开始时,关闭K1,开启K2和分液漏斗活塞,滴加苯和液溴的混合液,反应开始.过一会儿,在(Ⅲ)中可能观察到的现象是____________________________________
(2)整套实验装置中能防止倒吸的装置有________________(填装置序号).
(3)反应结束后要使装置(I)中的水倒吸入装置(Ⅱ)中.这样操作的目的是______________________
(4)你认为通过该实验后,有关苯跟溴反应的原理方面能得出的结论是_______________________
(每空2分,共12分)实验室以草酸(HOOC—COOH)和乙醇为原料制备草酸二乙酯的实验步骤如下:
步骤1:在上图所示装置中,加入无水草酸45g,无水乙醇81g,苯200mL,浓硫酸10mL,搅拌下加热68-70℃回流共沸脱水。
步骤2:待水基本蒸完后,分离出乙醇和苯。
步骤3:所得混合液冷却后依次用水、饱和碳酸氢钠溶液洗涤,再用无水硫酸钠干燥。
步骤4:常压蒸馏,收集182-184℃的馏分,得草酸二乙酯57g。
(1)步骤1中发生反应的化学方程式是,反应过程中冷凝水应从(填“a”或“b”)端进入。
(2)步骤2操作为。
(3)步骤3用饱和碳酸氢钠溶液洗涤的目的是。
(4)步骤4除抽气减压装置外所用玻璃仪器有蒸馏烧瓶、冷凝管、接液管、锥形瓶和。
(5)本实验中,草酸二乙酯的产率为。
工业上测量SO2、N2、O2混合气体中SO2含量的装置如下图;反应管中装有碘的淀粉溶液。SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI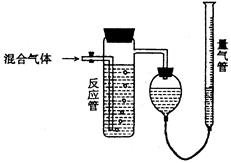
(1)混合气体进入反应管后,量气管内增加的水的体积等于的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的SO2含量(选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用代替(填写物质名称)。
(4若碘溶液体积为VamL.,浓度为Cmol·L-1,N2与O2的体积为VbmL(已折算为标准状况下的体积)。用C.Va.Vb表示SO2的体积百分含量为:。
(5)将上述装置改为简易实验装置,除导管外,还需选用的仪器为.(选下列仪器的编号)。
a.烧杯
b.试管
c.广口瓶
d.容量瓶
e.量筒
f.单孔塞
g.双孔塞