某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视_______ ________。直到因加入一滴盐酸后,溶液由黄色变为橙色,并_______________为止。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是_______________
| A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液 |
| B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
(3)若滴定开始和结束时,酸式滴定管中的液面如图所示:则起始读数为_________mL,终点读数为_____________mL;所用盐酸溶液的体积为______________ mL。
(4)某学生根据三次实验分别记录有关数据如下表:
请用上述数据列式计算该氢氧化钠溶液的物质的量浓度 。
(9分)某校课外活动小组为了探究铜与稀硝酸反应产生的气体主要是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空气的注射器。
请回答有关问题:
(1)设计装置A的目的是;为达到此目的,应进行的操作是。
(2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________________;B中反应的离子方程式为:__________________________。
(3)装置E和F的作用是;实验现象是______。(用化学方程式及必要文字简要描述)
(4)装置D的作用是。
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料。某化学小组用水杨酸(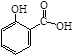 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率。
实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9 g (0.05 mol)水杨酸和24 g(30 mL,0.75 mol)甲醇,向混合物中加入约10 mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5 mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g。
常用物理常数:
| 名称 |
分子量 |
颜色状态 |
相对密度 |
熔点(℃) |
沸点(℃) |
| 水杨酸甲酯 |
152 |
无色液体 |
1.18 |
-8.6 |
224 |
| 水杨酸 |
138 |
白色晶体 |
1.44 |
158 |
210 |
| 甲醇 |
32 |
无色液体 |
0.792 |
-97 |
64.7 |
请根据以上信息回答下列问题:
(1)仪器A的名称是,制备水杨酸甲酯时,最合适的加热方法是。
(2)实验中加入甲苯对合成水杨酸甲酯的作用是。
(3)反应结束后,分离甲醇的操作是。
(4)洗涤操作中,第一次水洗的主要目的是,第二次水洗的主要目的是。
(5)检验产品中是否含有水杨酸的化学方法是。
(6)本实验的产率为___________(保留两位有效数字)。
.实验探究:为了研究同周期元素性质递变规律,某同学自己设计了一套实验方案,并动手记录实验步骤和现象如下:(表中的“实验步骤”与“实验现象”前后不一定是对应关系)
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色。 |
| ②在盛有冷水的烧杯中滴入几滴酚酞溶液,再将一小块金属钠放入其中 |
B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 |
C.剧烈反应,迅速产生大量无色气体 |
| ④将铝条投入稀盐酸中 |
D.反应不十分剧烈;产生无色气体。 |
| ⑤向A1Cl3溶液中滴加NaOH溶液至过量 |
E.生成白色胶状沉淀,继而沉淀消失 |
请你帮助该同学整理并完成实验报告:
(1)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、AlC13溶液、NaOH溶液、酚酞溶液等。
实验所用到的玻璃仪器:①、②、③以及胶头滴管、玻璃片等。
(2)实验内容:(填写与实验步骤对应的实验现象的编号和②的化学方程式)
| 实验内容 |
① |
② |
③ |
④ |
⑤ |
| 实验现象(填A~F) |
B |
(3)此实验的结论:钠、镁、铝的金属性强弱。
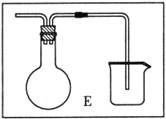
某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。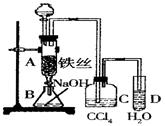
(1)写出A中反应的化学方程式______________________________;
(2)观察到D中的现象是______________________________;
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是____________,写出有关的化学方程式______________________________;
(4)C中盛放CCl4的作用是______________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入_______,现象是__________________。
氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能够引起燃烧。某活动小组准备使用下列装置制备LiH固体。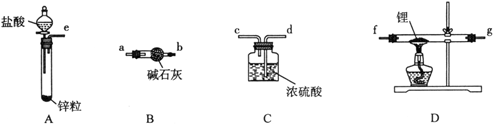
甲同学的实验方案如下:
(1)仪器的组装连接:上述仪器装置接口的连接顺序为____________________,加入药品前首先要进行的实验操作是__________(不必写出具体的操作方法);其中装置B的作用是______________。
(2)添加药品:用镊子从试剂瓶中取出一定量金属锂(固体石蜡密封),然后在甲苯中浸洗数次,该操作的目的是________________________________________,然后快速把锂放入到石英管中。
(3)通入一段时间氢气后加热石英管,在加热D处的石英管之前,必须进行的实验操作________。
(4)加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处。采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险。(反应方程式:LiH + H2O =" LiOH" + H2↑),分析该反应原理,完成LiH与无水乙醇反应的化学方程式______________________________________。
(5)准确称量制得的产品0.174g,在一定条件下与足量水反应后,共收集到气体470.4 mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为____________________。
(6)乙同学对甲的实验方案提出质疑,他认为未反应的H2不能直接排放,所以在最后连接了装置E用来收集H2,请将E装置补充完整。