(6分)CO和CO2的混合气体18 g,完全燃烧后测得CO2体积为11.2L(标准状况)。试回答:(1)混合气体中CO的质量是 。(2)混合气体中CO2在标准状况下的体积是 。(3)混合气体在标准状况下的密度是 。
氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式为________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮做氧化剂,反应产物是氮气和水。由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,则推进剂中联氨的质量________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O 6NO2+ 8NH3=7N2+12H2O。NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。则①该混合气体中NO与NO2的体积比为________,②吸收后氨水的物质的量浓度________(答案保留1位小数)。
实验室需要0.80 mol·L-1 NaOH溶液475 mL 和0. 40 mol·L-1硫酸500 mL。根据这两种溶液的配制情况回答下列问题: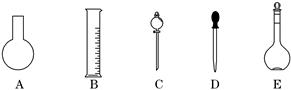
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填编号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
(2)容量瓶所不具备的功能有__________(填编号)。
| A.配制一定体积准确浓度的标准溶液 |
| B.量取一定体积的液体 |
| C.测量容量瓶规格以下的任意体积的液体 |
| D.贮存溶液 |
E.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度__________0.80 mol·L-1(填“大于”、“小于”或“等于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度____________0.80 mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。如果实验室有10 mL、15 mL、20 mL、50 mL的量筒,最好选用________mL的量筒。
将含有2.05 g某高价含氧酸的钙盐的溶液A与含1.20 g碳酸盐的溶液B混合,恰好完全反应,生成1.25 g白色沉淀C。将滤去沉淀C的滤液蒸发,得到白色固体D,继续加热D时,D分解只得两种气态物质的混合物,在0 ℃、1×105 Pa下,体积变为0.56 L,并得到0.90 g液态水,另一种气态物质为气态氧化物R2O。试回答:
(1)白色沉淀C的物质的量为________mol。
(2)A的摩尔质量为__________,B的摩尔质量为__________。
(3)R2O与H2O的物质的量之比为__________,生成D的质量为________,D的摩尔质量为________,R2O的相对分子质量为________,R2O的化学式是____________。
(4)写出A和B混合的化学方程式_____________________________________________。
正三价铁元素有一定的氧化性,FeCl3溶液吸收一定量SO2后溶液颜色发生变化。
(1)反应的离子方程式为_________________________________________________。
(2)除H+,OH-,H2O外,溶液中一定含有的微粒有________。
| A.Fe2+ | B.Fe3+ | C.Cl- | D.SO42— E.H2SO3 |
(3)对还不能确定的微粒存在情况提出合理的假设:
假设1:只存在Fe3+;
假设2:只存在______________________________________________________;
假设3:_____________________________________________________________。
(4)设计实验方案,进行实验。写出实验步骤以及预期现象和结论。
限选实验试剂:3 mol·L-1H2SO4,1 mol·L-1NaOH,0.01 mol·L-1KMnO4,
20%KSCN,3%H2O2,淀粉KI溶液、紫色石蕊试液、品红溶液。
| 实验步骤 |
预期现象和结论 |
| 步骤1: |
|
| 步骤2: |
口服抗菌药利君沙的制备原料G和某种广泛应用于电子电器等领域的高分子化合物Ⅰ的合成路线如下:
已知:①R—CH2—CH===CH2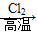 R—CHCl—CH===CH2
R—CHCl—CH===CH2
②R—CH2—CH===CH2 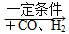 R—CH2CH2CH2CHO
R—CH2CH2CH2CHO
(1)A的结构简式是________,D中的官能团的名称是________。
(2)写出B―→C的化学方程式:___________________________________________,
该反应类型是____________________。
(3)H的分子式为C8H6O4,能与碳酸钠溶液反应放出气体,其一氯取代物只有一种,写出H的结构简式:_____________________________________________________
(4)写出E+H―→I的化学方程式:______________________________。
(5)J是比C多一个碳原子的C的同系物,J可能的稳定结构有________种(①考虑顺反异构;②“ ”结构不稳定),请任意写出其中一种的结构简式:______________。
”结构不稳定),请任意写出其中一种的结构简式:______________。
(6)关于G的说法中正确的是________(填序号)。
a.1 mol G可与2 mol NaHCO3反应
b.G可发生消去反应
c.1 mol G可与2 mol H2发生加成反应
d.G在一定条件下可与Cl2发生取代反应