为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)今有如下两个热化学方程式:则a b(填>, =" ," <)
H2(g)+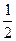 O2(g) = H2O(g) ΔH1=a kJ·mol-1
O2(g) = H2O(g) ΔH1=a kJ·mol-1
H2(g)+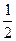 O2(g) = H2O(l) ΔH2=b kJ·mol-1
O2(g) = H2O(l) ΔH2=b kJ·mol-1
(2)由气态基态原子形成1mol化学键释放 的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g)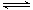 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值:_______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(s)和H2(g)生成1mol C2H2(g)反应的反应热
△H =____________________ __。
__。
(8分)已知A、B均是由两种元素组成的化合物,A中某种元素的质量分数为75%,B是一种淡黄色固体,C、J是同周期元素的气态氢化物,其中C是含氢量最高的烃,X为常见的无色液体。反应生成的水均已略去。它们有如下图所示的关系。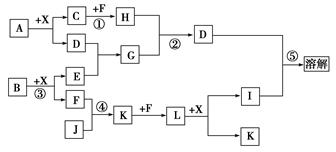
(1)写出化学式:A________,B________,J________。
(2)反应③中每生成1 mol F,转移电子的数目为______________。
(3)反应④的化学方程式为:______________________________。
(4)写出离子方程式:
反应②_______________________________________________;
反应⑤________________________________________________。
(5)反应①中,每1.00 g C与足量的F作用,恢复到25 ℃放出55.6 kJ热量,写出
反应①的热化学方程式。
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)
(1)写出下列物质的化学式:F,G。
(2)将混合物中两种金属分离开的最简单的方法是
(3)D→E的转化中,加入过量的X可能是。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)写出下列转化的化学方程式:
A→C:;
H→I:。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)C和E两种元素相比较,原子得电子能力较强的是(填元素名称),以下三种说法中,可以验证该结论的是(填写编号);
A.比较这两种元素的常见单质的沸点
B.二者形成的化合物中,C元素的原子显负价
C.比较这两种元素的气态氢化物的稳定性
(2)C与D形成的某种化合物可作潜水面具中的供氧剂,每生成标准状况下11.2LO2,消耗该化合物的质量为___________。
(3)A、B、C、E可形成两种酸式盐(均含有该四种元素),这两种酸式盐在水溶液中相互反应的离子方程式为。
甲、乙两位同学设计用实验确定某酸HA是弱电解质,存在电离平衡,且改变条件平衡发生移动。实验方案如下:
甲:取纯度相同,质量、大小相等的锌粒于两只试管中,同时加入0.1 mol·L-1的 HA、HCl溶液各10 mL,按图装好,观察现象
乙:①用pH计测定物质的量浓度均为0.1 mol·L-1 HA和HCl溶液的pH;
②再取0.1 mol·L-1的HA和HCl溶液各2滴(1滴约为1/20 mL)分别稀释至100 mL,再用pH计测其pH变化
(1)乙方案中说明HA是弱电解质的理由是:测得0.1 mol·L-1的HA溶液的pH1(填“>”、“<”或“=”);
(2)乙同学设计的实验第______步,能证明改变条件弱电解质平衡发生移动。甲同学为了进一步证明弱电解质电离平衡移动的情况,设计如下实验:①使HA的电离程度和c(H+)都减小,c(A-)增大,可在0.1 mol·L-1的HA溶液中,选择加入_________试剂(选填“A”“B”“C”“D”,下同);②使HA的电离程度减小,c(H+)和c(A-)都增大,可在0.1 mol·L-1的HA溶液中,选择加入_____试剂。
A. NaA固体(可完全溶于水)B.1 mol·L-1 NaOH溶液
C. 1 mol·L-1 H2SO4D.2 mol·L-1 HA
(3) pH=1的两种酸溶液A、B各1 mL,分别加水稀释到1000 mL,其pH与溶液体积 V的关系如图所示,则下列说法不正确的有
V的关系如图所示,则下列说法不正确的有
A.两种酸溶液的物质的量浓度一定相等
B.稀释后,A酸溶液的酸性比B酸溶液弱
C.若a=4,则A是强酸,B是弱酸
D.若1<a<4,则A、B都是弱酸
在一容积为3 L的密闭容器内加入0.3 mol的N2和0.9 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)  2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
2NH3 ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示:(1)根据图示,计算从反应开始到平衡时,平均反应速率v(NH3)________。(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为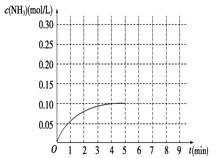
a.0.20 mol/L b.0.12 mol/Lc.0.10 mol/L d.0.08 mol/L
(3)反应达到平衡后,第5分钟末,保持其它条 件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数_(填“增大”、“减小”或“不变”)
件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数_(填“增大”、“减小”或“不变”)