近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 、 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 。 ⑸ 碱性蚀刻液在蚀刻过程中发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 。
⑸ 碱性蚀刻液在蚀刻过程中发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 。
向盛有少量FeCl3溶液的试管中滴加KSCN溶液,则溶液变成色,若向盛有少量FeCl2溶液的试管中滴加NaOH溶液,则会看到有色沉淀生成,在空气中该沉淀最终变成色,反应的化学方程式。
现有下列4种物质:① Cl2、② NO、③Na2O2、④Na2SO4溶液。其中,可用向上排空气法收集的气体是(填序号,下同);常温下为无色的气体是;与CO2反应产生的气体能使带火星木条复燃的是;加入BaCl2溶液产生白色沉淀的是。
现有下列4种物质:① NH3、② NO2、③Cl2、④NaHCO3溶液。其中,常温下为黄绿色气体是(填序号,下同),能使湿润的红色石蕊试纸变蓝的气体是,红棕色的气体是,与盐酸反应能生成气体的溶液是。
铝热反应在工业上有广泛应用:2Al+ Fe2O3 2Fe + Al2O3 。在该反应中,作为氧化剂的物质是(填化学式),作为还原剂的物质是(填化学式);若反应中生成了 2mol Fe,则需消耗mol Al。
2Fe + Al2O3 。在该反应中,作为氧化剂的物质是(填化学式),作为还原剂的物质是(填化学式);若反应中生成了 2mol Fe,则需消耗mol Al。
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。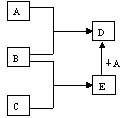
请回答:(1)若A为金属单质,B、C为非金属单质,且常温下B、C均为无色气体,D为黑色固体,则B的化学式为,A与E在一定条件下反应生成D的化学方程式为
。
(2)若A为非金属单质,且常温下为黄绿色气体,B为金属单质,C为酸,且C的组成中含有与A相同的元素。则构成非金属单质A的元素原子结构示意图为, A与E在一定条件下反应生成D的离子方程式为。