已知:
(1)该反应的生成物中含有的官能团的名称是__________,该物质在一定条件下能发生_______(填序号)。
①氧化反应 ②还原反应 ③酯化反应
(2)已知HCHO分子中所有原子都在同一平面内,若要使R1CHO分子中所有原子可能都在同一平面内,R1可以是________( 填序号)。
填序号)。 ①—CH3 ② ③—CH═CH2
①—CH3 ② ③—CH═CH2
(3)某氯代烃A的分子式为C6H11Cl,它可以发生如下转化:
 |
结构分析表明E分子中含有两个甲基且没有支链。
①写出A B的化学方程式:
B的化学方程式:
②E的结构简式为:
③写出D的同时符合下列条件的同分异构体的结构简式: a.属于二元醇; b.主链上有4个碳原子;
已知:①RCH=CH2+CO+H2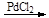 RCH2CH2CHO
RCH2CH2CHO
②

G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,可由A(分子式为C7H8O,能与FeCl3溶液发生显色反应)和烯烃D(分子式C4H8)等为原料制取,合成路线如下: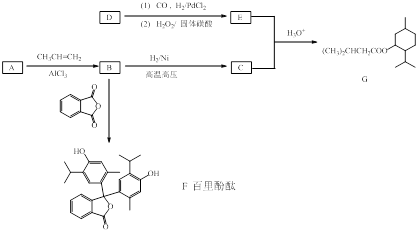
(1)A的名称为。
(2)F中含氧官能团名称和。
(3)D的结构简式为。
(4)某化合物是B的同分异构体,其分子中含有4种化学环境的氢原子,其对应的个数比为9∶2∶2∶1,写出该化合物的结构简式(任写一种)。
(5)正戊醛可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
有机物A是一种广谱高效食品防腐剂,如图所示是A分子的球棍模型。回答问题:
(1)①A的分子式:。
②A不能够发生反应的类型有______。(选填编号)
| A.氧化反应 | B.加成反应 | C.取代反应 | D.消去反应 |
(2)写出A与足量烧碱溶液反应的化学方程式:________。
(3)下列是一些中草药中所含的有机物:
其中互为同分异构体的是(选填编号)______;桂皮酸的一种同分异构体为 ,它与HBr气体1:1加成的产物可能有_________种。
,它与HBr气体1:1加成的产物可能有_________种。
(4)A的另一种同分异构体C遇FeCl3溶液显紫色;1 mol C可与 1 mol NaOH 反应生成有机物D;D被Ag(NH3)2OH溶液氧化后经酸化得有机物E,E经取代、消去两步反应可得香豆素。写出符合上述要求的二种C的结构简式:____________、。
为了预防碘缺乏症,国家规定每千克食盐中应含40~50mg碘酸钾。碘酸钾晶体有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂作用生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等强氧化剂氧化为更高价的碘的含氧酸盐。
【问题1】工业生产碘酸钾的流程如下:
(1)碘、氯酸钾和水混合后的反应为(未配平):I2+KClO3+H2O→KH(IO3)2+KCl+Cl2↑。该方程式配平时,系数有多组,原因是。
(2)X的化学式为;写出用试剂X调节pH的化学方程式:。
(3)生产中,如果省去“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应后溶液的pH,对生产碘酸钾有什么具体影响?。
【问题2】已知:KIO3+5KI+3H2SO4→3K2SO4+3I2+3H2O; I2+2S2O32-→2I-+S4O62-。
(4)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应。用四氯化碳检验碘单质时,看到的明显现象有。
(5)测定加碘食盐中碘的含量,学生乙设计的实验步骤如下:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入过量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL恰好反应。
则加碘食盐样品中的碘元素含量是mg/kg(以含w的代数式表示)。
(6)学生丙又对纯净的NaCl(不含KIO3)进行了下列实验:
| 操作步骤 |
实验现象 |
| 取1g纯净的NaCl,加3mL水配成溶液。 |
溶液无变化 |
| 滴入5滴淀粉溶液和1mL 0.1 mol·L-1 KI溶液,振荡。 |
溶液无变化 |
| 然后再滴入1滴1mol·L-1的H2SO4,振荡。 |
溶液变蓝色 |
①推测实验中产生蓝色现象的可能原因,用离子方程式表示。
②根据学生丙的实验结果,请对学生乙的实验结果作出简要评价:。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色。
(2)能说明第①步反应达平衡状态的是。(选填编号)
| A.Cr2O72—和CrO42—的浓度相同 | B.v正(Cr2O72—) ="2v" 逆(CrO42—) |
| C.溶液的颜色不变 | D.溶液的pH值不变 |
(3)写出第②步中Cr2O72-转变为Cr3+的离子方程式:。
(4)向Cr2(SO4)3溶液中,滴加NaOH,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的[Cr(OH)4]-离子。其平衡关系如下:
现向0.05mol·L-1的Cr2(SO4)3溶液50mL中,加入等体积0.6 mol·L-1的NaOH溶液,充分反应后,溶液中可观察到的现象为,溶液中离子浓度由大到小的顺序为。
(5)在Na[Cr(OH)4]和Na2Cr2O7混合后的溶液中加入H2SO4酸化,铬元素以形式存在(填写离子符号)。
金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(S/ mol·L-1)如图所示。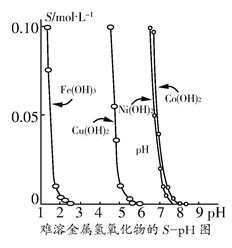
(1)pH=3时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:________________________。
(5)已知一些难溶物的溶度积常数如下表:
| 物质 |
FeS |
MnS |
CuS |
| Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-35 |
| 物质 |
PbS |
HgS |
ZnS |
| Ksp |
3.4×10-28 |
6.4×10-33 |
1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________。
A.NaOH B.FeS C.Na2S