铁及其化合物在日常生活、生产中应用广泛。
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的。按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3 + 3NaClO + 4NaOH ="=" 2Na2FeO4 + 3X + 5H2O, 则X的化学式 ,反应中 被氧化。
(2)氧化铁红颜料跟某些油料混合,可以制成防锈油漆。以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下: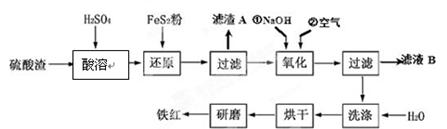
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为 ;
“滤渣A”主要成份的化学式为 。
②还原过程中加入FeS2的目的是将溶液中的Fe3 +还原为Fe2 +,而本身被氧化为H2SO4,请完成该反应的离子方程式:FeS2 + 14Fe3 + + H2O ="=" 15Fe2 + + SO42-+ 。
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为 。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
3.8 |
7.6 |
9.4 |
| 完全沉淀pH |
3.2 |
5.2 |
9.7 |
12.4 |
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,如果pH过大,可能引起的后果是 (几种离子沉淀的pH见下表);滤液B可以回收的物质有(写化学式) 。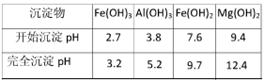
(1)质量数为23,中子数为12的原子的原子结构示意图:
(2)下列物质属于离子晶体,属于分子晶体的是,
原子晶体,金属晶体。
①铁 ②干冰 ③金刚石 ④铜 ⑤水晶 ⑥氯化钠 ⑦碘 ⑧氢氧化钠
利用下列反应:Fe+Cu2+===Fe2++Cu设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解质溶液自选),画出实验装置图,注明电解质溶液的名称和正负极材料,标出电子流动方向和电流方向,写出电极反应式。
利用碳棒、锌片和200ml稀硫酸组成原电池,将化学能转化为电能,当碳棒上共产生3.36L(标准状况)气体时,硫酸恰好全部被消耗。试计算:
(1)锌片的质量减少了多少?
(2)原稀硫酸溶液的物质的量浓度。
(3)有多少个电子通过了导线。
下图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
⑴在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
⑵地壳中含量最多的金属元素是 。
⑶写出②与④形成的化合物的电子式 。
⑷这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是,呈两性的氢氧化物是。
⑸写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式: 。
⑹写出⑤与氢氧化钠溶液反应的化学方程式:。
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量的热。已知0.4mol液态肼与足量的液态双氧水反应,生成氮气和水蒸气,放出QKJ的热量。
(1)反应的热化学方程式为
(2)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
(3)在西部大开发的十大工和中, ”西气东输”是其中之一.
”西气东输”中的”气”是指( )
| A.水煤气 | B.裂解气 | C.天然气 | D.电石气 |
(4)2001年2月24日,中央电视台报道:近年来北京的空气质量提高,已石家庄Ⅱ级标准.这主要得力于搬迁一此气超标排放的工厂和大量使用燃气燃料,减少了SO2和粉尘的排放,特别是使用了许多的环保型汽车,排放污染值大大降低.已知1g甲烷完全燃烧生成气态水时放出热量50.125KJ.试写出甲烷燃烧的热化学方程式