(1)将AgNO3溶液分别与HCl、NaCl、KCl溶液混合,均有 产生,它们的离子反应方程式 。
(2)锌粒投入 稀硫酸中,溶液里 离子的量减少, 离子的量增加, 离子的量没有变化.
稀硫酸中,溶液里 离子的量减少, 离子的量增加, 离子的量没有变化.
[化学——选修有机化学基础]
有机物A由C、H、O、Cl四种元素组成,质谱分析知其相对分子质量为198.5,红外光谱分析知其C1在侧链上。核磁共振氢谱有4个峰,峰面积之比是6∶2∶2∶1 。当A与C12分别在Fe作催化剂和光照条件下以物质的量之比为1∶1反应时,分别是苯环上一氯取代有两种和侧链上一氯取代有一种;A与NaHCO3溶液反应时有气体放出。A经下列反应可逐步生成B~G。
。当A与C12分别在Fe作催化剂和光照条件下以物质的量之比为1∶1反应时,分别是苯环上一氯取代有两种和侧链上一氯取代有一种;A与NaHCO3溶液反应时有气体放出。A经下列反应可逐步生成B~G。
(1)A的结构简式为__________;D的结构简式为__________。
(2)C→E的反应类型是:__________。(3)C中含氧官能团的名称为_______ 、__________。
(4)写化学方程式(有机物写结构简式):
[化学——选修物质结构与性质]
A、B、C、D为1~36号元素。A元素的原子价电子排带为ns2np2,B元素的最外层电子数是其电子层数的3倍,C元素原子的M电子层的p亚层中有3个未成对电子,D元素原子核外的M层中只有2对成对电子。
(1)当n=2时,AB2属于_____分子(填“极性”或“非极性”),分子中有____个σ键,____个π键。
(2)当n=3时,A与B形成的晶体属于_____晶体。
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素的第一电离能由大到小的顺序是___(用元素符号表示)。
(4)已知某红紫色配合物的组成为CoCl3·5NH3·H2O。该配合物中的中心离子钴离子在基态的核外电子排布式为____,作为配位体之一的NH3分子的空间构型为_____。
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为_____。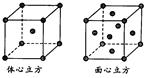
[化学——选修化学与技术]
技术的发展与创新永无止境。我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下图所示: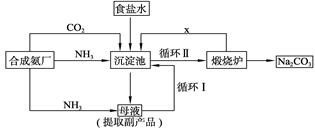
(1)向沉淀池中要通入CO2和氨气,应先通入__________(填化学式),原因是__________。
(2)沉淀池中发生反应的化学方程式是__________。
(3)母液中的溶质主要是__________,向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用是__________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环;物质x是__________,从沉淀池中提取沉淀的操作是__________。
(5)写出煅烧炉中发生反应的化学方程式__________。
(6)这样制得的产品碳酸钠中可能含有的杂质是__________(填化学式),为检验该杂质的存在,具体操作是__________。
(1)某科研小组研究在其他条件不变的情况下,改变起始氢气物质的量[用n(H2)表示]对N2(g)+3H2(g) 2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):
2NH3(g)反应的影响,实验结果可表示成如下图所示的规律(图中T表示温度,n表示物质的量):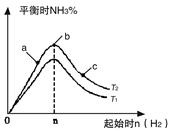
①比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是__________。
②若容器容积为1L,n=3mol,反应达到平衡时H2的转化率为60%,则在起始时体系中加入N2的物质的量为__________mol,此条件下(T2),反应的平衡常数K=__________。
③图像中T2和T1的关系是__________。(填“高于”、“低于”、“等于”、“无法确定”)。
(2)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图):
4NH3+5O2 4NO+6H2O
4NO+6H2O
4NH3+3O2 2N2+6H2O
2N2+6H2O
温度较低时以生成__________为主,温度高于900℃时,NO产率下降的原因是__________。
(3)现以H2与O2、熔融盐Na2CO3组成的燃料电池(如图所示,其中Y为CO2)装置进行电解。
写出石墨Ⅰ电极上发生反应的电极反应式:__________。
在电解池中生成N2O5的电极反应式为:__________。
如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应 ,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________;
(3)写出C→H的离子方程式:_______________;
(4)写出D与K反应生成的正盐溶液中的离子浓度大小关系:____________________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为_________;
某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。