在四个失去标签的试剂瓶中,分别盛有盐酸、AgNO3溶液、CaCl2溶液、K2CO3溶液。为了鉴别各瓶中的试剂,将它们分别编号为A、B、C、D,并两两混合反应,实验 现象如下:
现象如下:
① A和B混合,产生无色气体 ; ② C和B混合,产生白色沉淀
③ A和D混合,产生白色沉淀 ; ④ D和B混合,无明显变化
(1)由此推 断各瓶所盛放的试剂为(用化学式回答):(每空1分)
断各瓶所盛放的试剂为(用化学式回答):(每空1分)
A ,B ,C  ,D 。
,D 。
(2)写出下列变化的离子方程式:(每空2分)
①A和B混合: 
 。
。
②C和B混合: 。
③C和D混合:  。
。
A、B、C、D、E、F、G是七种短周期主族元素,它们的原子序数依次增大,其中在元素周期表中A的原子半径最小,B和F、C和G分别是同一主族元素,含有D元素的物质焰色反应为黄色,G元素的最外层电子数是次外层电子数的3/4。又知B元素的最外层电子数是内层电子数的2倍,D、E、G三者的最高价氧化物的水化物两两皆能反应。请回答:
(1)A与C形成的原子个数比为1:1的化合物的电子式为,该物质含
键;它与GC2反应的化学方程式为
(2)D、E两者氧化物的水化物反应的离子方程式为;
(3)B、F的最高价氧化物(填化学式)的沸点高,理由是
(4)A、C、G间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为。
广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图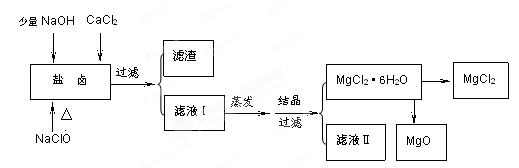
(1)滤液Ⅱ中所含主要的杂质离子是(写离子符号)。
(2) 加入NaClO的作用是。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g)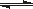 Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的?H =。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 。
A.升高温度B.降低压
C.加入更多的SiO2 D.充入N2
某温度下,测得该反应中N2和CO各个时刻的浓度如下,
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| N2浓度/mol·L-1[ |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
| CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
— |
— |
— |
求0—20 min内N2的平均反应速率V(N2 )=,该温度下,反应的平衡常数K=。
工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)若平衡体系的pH=2,则溶液显色.
(2)能说明第①步反应达平衡状态的是。
a.Cr2O72—和CrO42—的浓度相同 b.2v (Cr2O72—) ="v" (CrO42—) c.溶液的颜色不变
(3)第②步中,还原1mol Cr2O72—离子,需要________mol的FeSO4·7H2O。
( 4 ) 第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+ (aq)+3OH—(aq)
Cr3+ (aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)用Fe做电极的原因为。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)。
溶液中同时生成的沉淀还有。
已知:
①25℃时弱电解质电离平衡数:Ka(CH3COOH)= ,Ka(HSCN)=0.1,
,Ka(HSCN)=0.1,
难溶电解质的溶度积常数:Kap(CaF2)=
②25℃时, mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:
mol·L-1氢氟酸水溶液中,调节溶液pH(忽略体积变化),得到c(HF)、c(F-)与溶液pH的变化关系,如下图所示:

请根据以下信息回答下旬问题:图2
(1)25℃时,将20mL 0.10 mol·L-1 CH3COOH溶液和20mL 0.10 mol·L-1HSCN溶液分别与20mL 0.10 mol·L-1NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)变化的示意图为图2所示:
反应初始阶段,两种溶液产生CO2气体的速率存在明显差异的原因是。反应结束后所得两溶液中,c(CH3COO-)c(SCN-)(填“>”、“<”或“=”)
(2)25℃时,HF电离平衡常数的数值Ka ,列式并说明得出该常数的理由。
,列式并说明得出该常数的理由。
(3) mol·L-1HF溶液与
mol·L-1HF溶液与 mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化),
mol·L-1 CaCl2溶液等体积混合,调节混合液pH为4.0(忽略调节混合液体积的变化), 通过列式计算说明是否有沉淀产生。
通过列式计算说明是否有沉淀产生。
(是,否)有沉淀产生
列式计算(过程):