做钠在氯所中燃烧的实验时,钠完全反应后,在集气瓶内放少量水来吸收过量的
,但不能完全吸收。如何处理残余的
呢?同学们进行了相关探究。
【提出问题】
向上述集气瓶中滴入石蕊溶液,发现溶液显红色。由此想到,选用氢氧化钠等碱性溶液吸收
,效果会怎么样?
【查阅资料】
氯气是黄绿色有毒气体,溶于水,在饱和氯化钠溶液中的溶解度非常小。
【设计与实验】
用两套完全相同的装置做对比实验,如下图所示:

(1)为确保实验的准确性,要先检验装置的
(2)实验开始时,先用弹簧夹夹紧乳胶管,再将注射器内等体积的水和
溶液分别注入充满
的集气瓶;
(3)充分吸收
后,打开弹簧夹,观察进入两个集气瓶内饱和
溶液的体积。
【结论与解释】
(1)甲实验中,
溶于水且与水反应生成盐酸和次氯酸(
),反应的化学方程式为
(2)乙实验中,
与
易发生化学反应。
(3)分析实验现象得知,用碱性溶液比用水吸收
的效果
【交流与反思】
(1)金属钠在氯气中燃烧的实验现象为
(2)向
的水溶液中滴入硝酸银溶液有白色沉淀生成,化学方程式为:
【2015年河北省】同学们用高锰酸钾制氧气.制取结束清洗仪器.发现加热高锰酸钾的试管内壁有用水洗刷不掉的黑色固体.
问题一:黑色固体是什么?
【交流讨论】同学们结合实验现象和对高锰酸钾及其分解产物的了解.进行分析判断.
| 判断 |
依据 |
| 不是KMnO4 |
KMnO4能溶于水形成紫红色溶液 |
| 不是 (填化学式) |
冲洗试管时出现深绿色溶液,说明该物质能溶于水 |
| 是MnO2 |
其他实验用过MnO2,知道它是不溶于水的黑色固体 |
【实验验证】向未洗净的试管中加入某种液体,产生能使带火星木条复燃的气体.证明上述判断正确.加入的液体是 .
问题二:用什么洗掉MnO2?
【交流讨论】MnO2与BaCO3、Mg(OH)2、Fe2O3、P2O5、Cu中的某一种物质组成最相近,理由是 .这种物质能与稀盐酸反应,化学方程式为 ,由此推测MnO2也能与稀盐酸反应.
【实验验证】向未洗净的试管中加入稀盐酸,黑色固体没有变化.
【交流讨论】实验说明同一类物质的化学性质不一定相同.MnO2有什么化学性质,用什么试剂清洗呢?同学们请教老师后决定用草酸(H2C2O4)溶液试一试.
【实验验证】向未洗净的试管中加入草酸溶液,黑色固体果然被除去,同时发现产生许多气泡.
问题三:生产了什么气体?
【交流讨论】化学变化过程中元素不变,因为 ,所以产生的气体可能为CO2、CO、H2、O2等.
【实验验证】经检验,产生的气体是CO2,检验CO2气体的操作和现象是: .
【反思提高】以上探究活动中,清除试管内壁附着的难溶物的思路是:先 ,再了解其化学性质,然后选择合适试剂进行清洗.
某研究性学习小组,选择“过氧化氢(H202)生成氧气(02)的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程。
【假设】过氧化氢生成氧气的快慢与催化剂的种类有关。
【实验方案】常温下,在两瓶相同体积的过氧化氢(H202)溶液中分别加入相同质量的二氧化锰(MnO2)和红砖粉,测量各生成一瓶(相同体积)氧气所需的时间。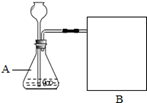
【进行实验】上图是他们进行实验的装置图,气体发生装置中A仪器的名称是__________ ,此实验中B处宜采用的气体收集方法是_______________。
【实验记录】
| 实验编号 |
1 |
2 |
| 反应物 |
6%过氧化氢(H202) |
6%过氧化氢(H202) |
| 催化剂 |
1g 二氧化锰 |
|
| 时间 |
35s |
152s |
【结论】该探究过程得出的结论是__________________________
【反思】过氧化氢在常温下分解缓慢,加入二氧化锰或红砖粉后反应明显加快,若要证明二氧化锰(MnO2)和红砖粉是该反应的催化剂,还需增加实验来验证它们在化学反应前后的 ________ 和 ________ 是否改变。
养鱼师傅有时会向鱼塘中撒一种微黄色的固体(主要成分为过氧化钙)。
【查阅资料】过氧化钙能与水能缓慢反应生成氢氧化钙和一种气体。
【提出问题】该固体的作用是什么?该反应吸热还是放热?
【实验探究】某同学用如右图所示的装置进行实验,打开仪器a的活塞,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,烧杯中的导管口有气泡产生。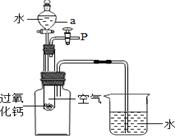
【分析讨论】
(1)按要求装配好仪器,实验前首先要 。
(2)过氧化钙与水反应产生的气体是 ;写出反应的文字表达式 。
(3)该反应 反应。(选填“吸热”或“放热”)
(4)养鱼师傅向鱼塘中撒过氧化钙的目的是 。
【拓展思考】
(5)养鱼师傅说一般在温度比较高的夏天使用过氧化钙较多,说明氧气的溶解能力随着温度的升高而 (填“增大”或“减小”)
(6)过氧化钙应 保存。
氧气是生产生活中重要的物质。
(1)氧气有很多用途。下列属于氧气用途的是 和 (填序号)。
| A.医疗急救 | B.食品防腐 | C.航天火箭 | D.霓虹灯 |
(2)氧气能跟很多物质反应。根据下图所示实验,并阅读资料,回答下列问题。
Ⅰ.小明对图1铁丝在氧气中燃烧为什么会火星四射进行探究。下表是他将纯镁条和不同含碳量的铁丝(镁条和铁丝直径均为0.4mm)放入氧气中燃烧时的实验现象的记录.请你分析回答:
| 物质 |
镁条 |
含碳0.05%的铁丝 |
含碳0.2%的铁丝 |
含碳0.6%的铁丝 |
| 燃烧时 的现象 |
剧烈燃烧,发出 耀眼白光,无火星 |
剧烈燃烧 极少火星 |
剧烈燃烧 少量火星 |
未填 |
①表中“未填”部分的内容应为__ ___;
②铁丝在氧气燃烧的文字表达式是___ 。
集气瓶底部放少量水或细沙的作用是______________________
③通过以上探究,你认为铁丝燃烧产生火星四射现象的原因可能是__ ____。
Ⅱ.图2中的反应现象为 ,反应的文字表达式为 ,集气瓶中加入的液体可能是 ,其主要目的是___ 。
空气中氧气含量测定的再认识。
【实验回顾】实验室用红磷燃烧来测定空气中氧气含量。
(1)写出红磷燃烧的化学方程式 (33) 。
(2)实验原理:红磷燃烧消耗氧气,使瓶内 (34) 减小,烧杯中水倒吸到集气瓶。若装置的气密性良好,操作规范,用量筒测量进入瓶中水的体积,能粗略测得空气中氧气的含量。
【问题提出】有资料表明:燃烧过程中当氧气体积分数低于7%时,红磷就无法继续燃烧,因此通过上述实验,测置结果与理论值误差较大。
【实验改进】
Ⅰ. 根据铁在空气中生锈的原理设计右图实验装置,再次测定空气中氧气含量。装置中饱和食盐水、活性炭会加速铁生锈。
Ⅱ.测得实验数据如下表
| 测量项目 |
实验前 |
实验后 |
|
| 烧杯中 水的体积 |
烧杯中 剩余水的体积 |
集气瓶(扣除内容物) 和导管的容积 |
|
| 体积/mL |
80.0 |
54.5 |
126.0 |
【交流表达】
(1)铁生锈过程首先是铁与氧气、水反应生成氢氧化亚铁[Fe(OH)2],写出该反应的化学方程式 。
(2)根据表中数据,改进实验后与铁反应的氧气为 mL,空气中氧气的体积分数是 (计算结果精确到0.1%)。
(3)从实验原理角度分析,改进后的实验结果比前者准确度更髙的原因可能是: 。