在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。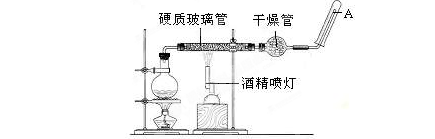
请回答该实验中的问题。
(1)写出该反应的反应方程式: ;并指明该氧化还原反应的还原剂是 ,氧化剂是 ,假设有1mol氧化剂参加反应,转移的电子数的物质的量为 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是 。
(3)酒精灯和酒精喷灯点燃的顺序是 ,为什么? 。
(4)干燥管中盛装是的物质是 ,作用是 。
。
(5)某次实验后,取硬质玻璃管中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因 。
某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液。
②用标准液滴定至终点,记录滴定管液面读数,所得数据如下表:
| 滴定次数 |
盐酸 体积 体积 |
NaOH溶液体积读数(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.00 |
18.10 |
| 2 |
20.00 |
0.00 |
16.30 |
| 3 |
20.00 |
0.00 |
16.22 |
请回答下列问题:
(1)步骤①中,量取20.00mL待测液应使用________________(填仪器名称),若在锥形瓶装液前残留少量蒸馏水,将使测定结果_______________(填“偏大”、“偏小”或“无影响”)。
(2)步骤②中,滴定时眼睛应注视________________(填仪器名称),判断到达滴定终点的依据是___________________________________________。
(3)第一次滴定记录的NaOH溶液的体积明显多于后两次的体积,其可能的原因是_______________________(填字母)
A.滴定前滴定管尖嘴有气泡,滴定结束时无气泡
B.锥形瓶装液前用待测液润洗
C.NaOH标准液保存时间过长,有部分Na2CO3生成
D.滴定终点时,俯视读数
(4)根据上表记录数据,通过计算可得该盐酸的浓度为______ mol·L-1。
某研究性学生小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO42CaSO4+2Cl2↑+2H2O他们设计了如图所示装置制取氯气并验证其性质的实验。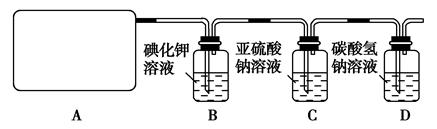
试回答:
(1)该实验中A部分的装置是________(填写装置的序号);
(2)B中反应的化学方程式是。
(3)写出C中反应的离子方程式,并请你帮该小组同学设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):_________________。
(4)写出在D装置中发生反应的离子方程式。
(5)该实验存在明显的缺陷是__________________________________。
(6)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L-1的Na2S2O3溶液做标准溶液滴定反应生成的碘,已知反应式为2Na2S2O3+I2===Na2S4O6+2NaI,反应完成时,共消耗Na2S2O3 200 mL。则该漂白粉中Ca(ClO)2的质量分数为________。
(10分)某活动课程小组拟用50 mL NaOH溶液吸收CO2气体,制备Na2CO3溶液.为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25 mL)NaOH溶液,使其充分混合反应.
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式_________________.
此方案第一步的实验装置如下图所示:
(2)加入反应物前,如何检验整个装置的气密性:________________________________________________________________________
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是______,作用是_____________________________________________
(4)在实验室通常制法中,装置A还可作为下列______(填序号)气体的发生装置.
①HCl ②H2 ③O2 ④NH3
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g/mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为_______mol/L.
测定SO2转化成SO3的转化率可以用下图装置,装置中烧瓶内发生的化学反应方程式为:Na2SO3(s)+H2SO4(85%)=Na2SO4+H2O+SO2↑。
(已知SO3的熔点是16.8℃,沸点是44.8℃)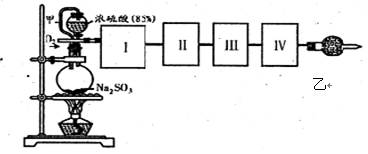
(1)装置中甲管的作用是;
乙装置的作用是。
(2)根据实验需要,应该在I、II、Ⅲ、IV处连接合适的装置,请从下图A~E装置中选择最适合装置并将其序号填放下面的空格中。I、Ⅱ、Ⅲ、Ⅳ处连接的装置分别是、、、。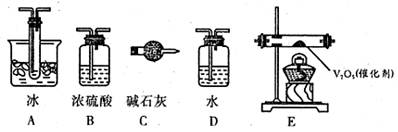
(3)为使SO2有较高的转化率,实验中加热 催化剂与滴加浓硫酸的顺序中,应采取的操作
催化剂与滴加浓硫酸的顺序中,应采取的操作 是,若用大火加热烧瓶时,SO2的转化率会(填“升高”、“不
是,若用大火加热烧瓶时,SO2的转化率会(填“升高”、“不 变”或“降低”)。
变”或“降低”)。
(4)将SO2通入含1 mol氯酸的溶液中,可生成一种强酸和一种氧化物,并有6.02×1023个电子转移,则该反应的化学方程式为。
(5)用nmolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅳ增重了mg,则实验中SO2的转化率为。(用含m、n的代数式填写)
从固体混合物A出发可以发生如下框图所示的一系列变化。
(1)在实验室,气体C的检验方法是。
(2)操作②的名称是,该操作所使用的玻璃仪器有。
(3)写出下列反应的离子方程式:
反应③;
反应④。
实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是(填序号)。