根据下面的反应路线及所给信息填空。
(一氯环已烷)
(1)A的结构简式是 ,名称是 。
(2)①的反应类型是 ;②的反应类 型是 ;
型是 ;
③的反应类型是 ;④的反应类型是 ,
(3)反应④的化学方程式是
(16分)氧化铁在工业上具有广泛的应用。
I.据报道,一定条件下利用FeO2与甲烷反应可制取“纳米级”的金属铁。其反应如下:
Fe2O3(s)+3CH4(g)=2Fe(s)+3CO(g)+6H2(g)△H>0
(1)若反应在2L的密闭容器中进行,5min后达到平衡,测得反应生成Fe的质量为l.12g。则该段时间内CH4的平均反应速率为 ________________。
(2)反应达到平衡后,保持其他条件不变,仅改变某一相关元素,下列说法正确的是___(选填序号)。
a.若加入催化剂,v正增大,平衡向右移动
b.若温度升高,平衡常数K减小
c.若增大Fe2O3的量,平衡向右移动
d.若从反应体系中移走部分CO,可提高CH4的转化率
Ⅱ.工业上利用硫铁矿烧渣(主要成分为Fe2O3、A12O3、SiO2等)为原料提取Fe2O3,工艺流程如下:试回答下列问题: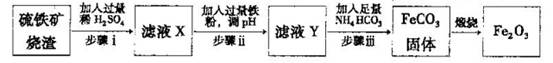
(3)步骤i烧渣中A12O3溶解的离子方程式为________________。
(4)步骤i、ⅱ、ⅲ都要进行的操作名称是__________________。
(5)结合下图,判断步骤ⅱ中调节溶液的pH不高于_________________。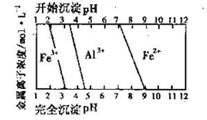
(6)已知
| 微粒平衡 |
平衡常数 |
FeCO3(s) Fe2+(aq)+CO32-(aq) Fe2+(aq)+CO32-(aq) |
Ksp=3.2×10-11 |
H2CO3 H++HCO3- H++HCO3- |
Ka1=4.36×10-7 |
HCO3- H++CO32- H++CO32- |
Ka2=4.68×10-11 |
2HCO3- H2CO3+CO32- H2CO3+CO32- |
K=1.3×10-4 |
计算反应Fe2+(aq)+2HCO3-(aq) FeCO3(s)+H2CO3(aq)的平衡常数为_______。
FeCO3(s)+H2CO3(aq)的平衡常数为_______。
(7)在空气中煅烧FeCO3生成氧化铁的化学方程式为____________。
(8)结合所学化学知识,请你设计在实验室里从上述的硫铁矿烧渣中提取氧化铁的另一种简单方案。
PET学名聚对苯二甲酸乙二醇酯( )具有优良的特性(耐热性、强韧性、电绝缘性、安全性等),且价格便宜,广泛用作纤维、薄膜、工程塑料、聚酯瓶等,某科研小组利用以下流程合成流程PET(部分试剂和反应条件略去)。
)具有优良的特性(耐热性、强韧性、电绝缘性、安全性等),且价格便宜,广泛用作纤维、薄膜、工程塑料、聚酯瓶等,某科研小组利用以下流程合成流程PET(部分试剂和反应条件略去)。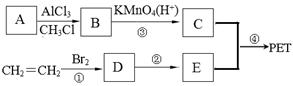
已知:
①在相同条件下芳香烃A的蒸汽密度是氢气密度的46倍;
②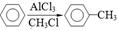 ;
;
回答下列问题:
(1)A的结构简式为___________;B的系统命名为____________;E中含有的官能团名称是______。
(2)写出反应④的化学方程式并注明反应类型:______________,____________;
(3)利用已知信息②完善下列方程式: 。
。
(4)下列有关说法正确的是_________;
a.D能能发生消去反应、取代反应
b.E可用于配制化妆品
c.乙烯分子中σ键和π键的个数之比是2:1
d.检验D中官能团的方法是加碱液并加热,用硝酸酸化后,再加入硝酸银溶液
(5)写出满足下列条件的C的所有同分异构体______________________________________。
①分子中有苯环但无其它环状结构;②能在酸或碱溶液中水解;
③1mol分子最多可与4mol NaOH反应。
X、Y、Z、W都是元素周期表中的前四周期元素,它们的核电荷数依次增大。X原子的最外层p轨道的电子为半充满结构,Y是地壳中含量最多的元素。Z元素形成的一种化合物常用作净水剂。W元素是第四周期元素中未成对电子数最多的元素,WCl3能与X、Y的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,1mol配合物与足量的AgNO3溶液反应能生成3molAgCl。请回答下列问题:
(1)XH3可作低温溶剂,它易液化的原因是__________________,Y所在周期中第一电离能最大的主族元素是____________________。
(2)XY3-离子的立体构型是__________,其中心原子采取 杂化。
(3)W3+的核外电子排布式是 ,WCl3形成的六配位的配合物化学式为 。
(4)某种Z—Fe合金的晶胞如图所示,该合金的化学式为 。若晶胞的边长为a nm,则合金的密度为 g• cm-3
(选做)【化学—有机化学基础】
有机物H是用于合成药物的中间体,G为合成涤纶。请根据下列转化关系回答有关问题:
已知以下信息:
①B能与碳酸氢钠溶液反应产生二氧化碳,其苯环上一氯代物只有2种
②G为C和F一定条件下1:1反应生成的高分子化合物
③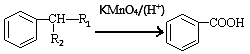
(-R1、-R2表示氢原子或烃基)
(1)A的化学名称为 ;C中含氧官能团名称为 。
(2)H的结构简式为 ;A→D的反应类型为 。
(3)写出C和F反应生成高分子化合物的化学方程式 。
(4)同时符合下列条件的B的同分异构体共有 种(不考虑立体异构);
①能发生银镜反应②含有苯环结构③能在碱性条件下水解
(5)其中核磁共振氢谱中出现4组峰,且峰面积之比为3:2:2:1的是 (写出结构简式)。
(选做)【化学—物质结构与性质】
已知:A、B、C、D、E、F六种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;元素D与元素A同主族;F能形成红色(或砖红色)的F2O和黑色的FO两种氧化物。
回答下列问题:
(1)F正一价离子的电子排布式为 。
(2)B、C、D的第一电离能由小到大的顺序为 。(用元素符号表示)
(3)A的简单氢化物分子极易溶于水,其主要原因是 .
(4)E的最高价氧化物分子的空间构型是 。其中心原子的杂化方式为 。
(5)A、F形成某种化合物的晶胞结构如图所示,
则其化学式为 ;(黑色球表示F原子),已知紧邻的白球与黑球之间的距离为a cm, 该晶胞的密度为 g/cm3。