工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法
该法的工艺流程为
其中第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
(1)该反应体系的平衡常数表达式为:
(2)若平衡体系的pH=2,则溶液显 色.
(3)能说明第①步反应达平衡状态的是 。
a.溶液的颜色不变 b.2v (Cr2O72—) ="v" (CrO42—)
c. Cr2O72—和CrO42—的浓度相同
(4)完成第②步反应的离子方程式:
__Cr2O72—+ __Fe2+ +_____="__" Cr3+ + __Fe3+ +__ H2O
(5)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) Cr3+(aq)+3OH—(aq)
Cr3+(aq)+3OH—(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)· c3(OH—)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
方法2:电解法
该法用Fe做电极电解含Cr2O72—的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(6)写出电解过程中的电极反应式:
阳极: 。阴极: 。
(7)溶液中同时生成的沉淀还有 。
已知柠檬醛的结构简式为: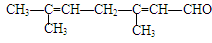
(1)1mol柠檬醛可与mol溴发生加成反应;
(2)柠檬醛完全加氢后,生成物的名称是;
(3)柠檬醛与新制的Cu(OH)2悬浊液反应的化学方程式是
;
(4)若要用实验证明柠檬醛中含有碳碳双键,正确的操作是
已知某有机物的式量是58,根据下列条件回答有关问题:
(1)若该有机物只由碳、氢两种元素组成,写出所有可能的结构简式为、。
(2)若该有机物为含氧衍生物,则分子中有2个—CH3,则结构简式为。
(3)若该含氧衍生物的分子中无—CH3,又无—OH,但能发生银镜反应,则结构简式为。
A、B、C、D、E五种微粒,它们可能是原子或离子,并且所含的元素都在短周期。A显负价时,不能被任何氧化剂氧化;金属B的原子核内质子数比前一周期的同族元素多8,其单质不能从CuSO4溶液中置换出Cu;C元素有三种同位素,Cl、C2、C3,C1的质量数分别为C2、C3的1/2和1/3;D的气态氢化物溶于水后显碱性;E是由两种不同元素组成的带负电荷的微粒,它共有10个电子,E极易与C+结合成中性微粒。回答:
(1)写出五种微粒的符号:A、B、C、D、E。
(2)C的同位素名称:C2。
(3)C和D形成分子的电子式为,空间结构为。
(1)现有如下两个反应:
A.NaOH + HCl =" NaCl" + H2O B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因
(2)如图所示装置,烧杯中盛有滴有酚酞的NaCl饱和溶液,C(1)、C(2)为多孔石墨电极。
①接通S1后,两极均有气体生成,C(1)附近溶液显 色。装置内发生的总反应化学方程式为 。
②若有11.7g NaCl发生反应,理论上生成Cl2的体积(标准状况)为 。
③反应一段时间后(电极未脱离液面),断开S1,接通S2,观察到二极管发光。此时:C(2)的电极反应式是 。
甲、乙、丙、丁分别是乙烷、乙烯、乙炔、苯中的一种;
(1)甲、乙能使溴水褪色。乙与等物质的量的H2反应生成甲,甲与等物质的量的H2反应生成丙。
(2)丙既不能使Br2的CCl4溶液褪色,也不能使KMnO4酸性溶液褪色。
(3)丁既不能使Br2的CCl4溶液褪色,也不能使KMnO4酸性溶液褪色,但在一定条件下可与溴发生取代反应。1mol丁可以和3molH2完全加成。
据以上叙述完成下列填充:
甲的结构简式乙的结构式丙的电子式
丁与液溴发生取代反应的方程式