某兴趣小组的化学探究浓硫酸与铁钉(碳素钢)反应后产生气体的成分。
【查阅资料】①Fe与浓H2SO4 反应,加热,有SO2生成 ,
②C与浓H2SO4 反应,加热,有CO2和SO2生成,
③SO2 可使澄清石灰水变浑浊,
④SO2可使口红溶液的红色褪去,而CO2不能。
⑤SO2可使酸性高锰酸钾溶液褪色,而CO2不能。
⑥碱石灰的主要成分是NaOH和CaO
【实验探究】称取24.0克铁钉放入60.0ml浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学通过实验测定并推知气体Y中SO2的体积分数为66.7%。同学们认为气体Y中还可能含有H2和Z气体,则Z气体可能是 。探究实验的主要装置如下图所示: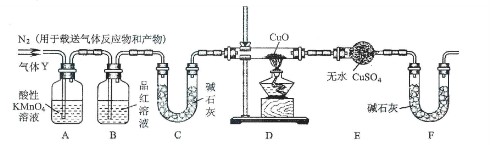
⑵装置A中试剂的作用是 。
⑶为确认Z的存在,需将装置甲(如图所示)拉入上述装置(填编号) 之间。装置甲中的液体名称是 。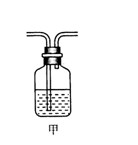
⑷在实验中,如果观察到装置D中 ,且装置E中 ,则可确认Y中含有H2气体。
⑸如果需要测定限定体积气体Y中H2的含量,(H2约为0.01克)。除可用测量
H2体积的方法外, (选填“能”或“不能”)用称量上图装置D装置E的质量变化的方法,通过计算并说明你判断的理由。
如下图所示进行实验,同时将针筒内全部液体迅速注入容器中,实验内容如下表所示.
| 实验编号 |
容器I |
针筒I |
容器Ⅱ |
针筒Ⅱ |
| a |
二氧化碳(充满) |
10mL澄清石灰水 |
二氧化碳(充满) |
10mL水 |
| b |
0.65g锌 |
15mL盐酸 |
0.24g镁 |
15mL盐酸 |

实验开始前红墨水左右两端液面保持相平.容器Ⅰ、Ⅱ体积相同,装置气密性良好.
(1)实验a中,容器Ⅰ内产生的现象是________________________,红墨水液面位置发生变化的原因是________________________________(用化学方程式表示).
(2)实验b中,针筒Ⅰ、Ⅱ内盐酸足量且溶质质量分数相同,产生气泡更剧烈的容器是________(填“I”或“Ⅱ”),红墨水的位置变化情况是________________________________________________________.
某化学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50g 5%的氯化钠溶液.
实验一:下图是同学们做粗盐提纯实验的操作示意图.
请回答下列问题:
(1)操作③中用玻璃棒的作用是________________________.
(2)操作⑥中的错误是________________________.
(3)粗盐提纯实验的操作顺序为(填操作序号)________________、称量精盐并计算产率.
(4)操作④中,当观察到________时停止加热.
实验二:用提纯得到的精盐配制了50g 5%的氯化钠溶液.经检测,溶质质量分数偏小,其原因可能有________(填序号).
①氯化钠固体仍然不纯
②称量时砝码端忘垫质量相同的纸片
③量取水时,仰视读数
④装瓶时,有少量溶液洒出
2013重庆)李兴同学将BaCl2溶液与稀H2SO4溶液混合,得到一种浊液,该反应的化学方程式为________________________________.李兴又将浊液过滤,并探究滤液的成分.
[提出猜想]
猜想1:滤液里的溶质只有HCl;
猜想2:滤液里的溶质有HCl和H2SO4;
猜想3:滤液里的溶质有HCl和________.
[设计实验验证]
加入锌粒
操作1:滤液 验证猜想2
验证猜想2
加入Na2SO4溶液
操作Ⅱ:滤液 验证猜想3
验证猜想3
其中操作________不能达到实验目的,应该将药品更换成________(填序号).
| A.AgNO3溶液 |
| B.BaCl2溶液 |
| C.NaHCO3固体 |
| D.金属铝 |
某实验小组开展了如下有关碱的化学性质探究活动:
(1)实验1的目的是________________________________.
(2)实验2中发生反应的化学方程式是________________________________________
________________________________________________________________________.
(3)实验3中观察到溶液由红色变为无色后,小萍想知道反应后溶液中除NaCl外,是否还含有其他溶质(不考虑酚酞),于是她向反应后的溶液中加入一种试剂,从而得出了结论.小萍加入的试剂可能是________.
(4)通过上述实验探究活动,可以总结出碱的化学性质如下:
①碱能与酸发生中和反应;
②________________________________________________________________________.
……
(5)准备实验时,小英发现药品室有两瓶未标注浓度的氢氧化钠溶液,经询问老师得知,该两瓶溶液的溶质质量分数分别为5%和10%.请你设计实验方案完成对这两瓶溶液的鉴别(仅限以下实验用品:试管、量筒、滴管、酚酞溶液、10%盐酸).
| 实验步骤 |
预计现象及相应结论 |
| ________________ ________________ ________________ |
__________________________ ______为5%的氢氧化钠溶液,另一种为10%的氢氧化钠溶液 |

暖宝宝是一种防寒用品,如图所示.暖宝宝中的主要成分有哪些?发热的原因是什么?
(1)小明探究:暖宝宝中的主要成分是什么?剪开内包装袋,倒出其中的粉末,发现呈黑色.
[提出猜想]该黑色粉末可能含有炭粉、铁粉、二氧化锰、氧化铜、四氧化三铁中的一种或几种.
[初步验证]将磁铁靠近黑色粉末,部分被吸引.
[查阅资料]四氧化三铁具有磁性,能被磁铁吸引.
[得出结论]该黑色粉末可能含有________.
[进行实验]
| 实验编号 |
实验操作 |
实验现象 |
| ① |
取黑色粉末加足量稀硫酸 |
固体部分溶解,有气泡产生,溶液无蓝色 |
| ② |
取实验①的残渣灼烧,将内壁涂有澄清石灰水的小烧杯罩在上方 |
澄清石灰水变浑浊 |
由实验①可知,该黑色粉末肯定含________,肯定不含________.写出实验①的化学反应方程式________.
由实验②可知,该黑色粉末肯定含________.
(2)小明思考:暖宝宝为什么会发热?
[查阅资料]暖宝宝中的铁粉在空气中发生了缓慢氧化,进而放出热量.由此可见,人们可以利用化学反应放出的能量,请再举一例:________.
(3)人们利用化学反应还可以________.