NM-3和D-58是正处于临床试验阶段的小分子抗癌药物,结构如下: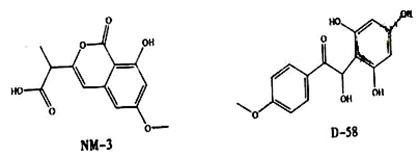
关于NM-3和D-58的叙述,错误的是( )
| A.都能与NaOH溶液反应,原因不完全相同 | B.都能与溴水反应,原因不完全相同 |
| C.都不能发生消去反应,原因相同 | D.遇FeCl3溶液都显色,原因相同 |
下列离子方程式中,正确的是
| A.碳酸氢钠在水中的电离:NaHCO3=Na++H++CO32- |
| B.钠与水的反应:2Na+2H2O=2Na++2OH-+H2↑ |
| C.氯气和水的反应:Cl2+H2O=2H++Cl-+ClO- |
| D.铝和烧碱溶液的反应:Al+2OH-=AlO-2 + H2↑ |
下列有关金属的说法中,不正确的是
| A.钠是一种强还原剂,可以把钛、锆、铌等从其熔融盐中置换出来 |
| B.镁铝合金常用作宇宙飞船、火箭、导弹、飞机中某些部件的金属材料 |
| C.铜能与氯化铁溶液反应,该反应可应用于印刷电路板的制作 |
| D.铁能与硫酸发生反应,不能用铁制容器贮存浓硫酸 |
要鉴别无瓶签的四氯化碳、苯、酒精、乙酸四瓶液体,下列一种试剂就可行的是
| A.水 | B.石蕊试液 | C.氢氧化钠溶液 | D.溴水 |
下列有关化学用语正确的是
| A.质子数为17、中子数为20的核素1737Cl |
B.Cl的结构示意图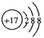 |
| C.乙烯的结构简式 C2H4 |
D.CO2的电子式 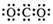 |
下图为元素周期表的局部,A、B、C、D为周期表中短周期元素,已知A原子最外电子层上的电子数是其次外层的一半。据此判断下列正确的是
| B |
D |
||
| A |
C |
A.A位于第2周期1A族 B.B的最高价氧化物的水化物是弱酸
C.原子半径A>C>B>DD.气态氢化物的热稳定性B>D>C>A