下图所示水槽中试管内有一枚铁钉,放置数天后观察: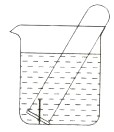
(1)铁钉在逐渐生锈,则铁钉的腐蚀属于 腐蚀。
(2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,正极反应式为 。
X、Y、Z是中学化学中常见的单质或化合物,它们能实现
如图所示的转化关系:
(1)若X是一种金属单质,X、Z分别与一种阴阳离子均为10电子物质的溶液反应都能生成Y。
①写出Y的化学式______________________,
②写出单质X与铁红反应的化学方程式________________________________________,
③写出反应I的离子方程式___________________________________________________。
(2)若Y是一种黄绿色气体,X是黑色粉末,Z是一种呈碱性的钠的化合物且能用于漂白物质。
①写出II的离子方程式______________________________________________________,
②反应I中若有0.1molX参加反应,生成Y气体的体积是____________(STP),
(3)X、Y、Z三种物质中含有同一种元素,Z为非金属单质,Y为气体,则Z为________,反应II的化学方程式为_______________________________________________________。
用新制的氯水进行下列实验,将可能产生的现象以及对现象的解释或子方程式填入下表。
| 实验内容 |
实验现象 |
解释或离子方程式 |
| 滴加AgNO3溶液 |
① |
② |
| 滴在蓝色的石蕊试纸上 |
③ |
④ |
| 与KI淀粉溶液反应 |
⑤ |
⑥ |
下图表示某种盐C的制备及其性质的实验步骤:
已知:盐C溶液呈黄色;沉淀D焙烧分解,生成红棕色粉末E。
(1)请写出下列物质的化学式:
A,B,C,D,
(2)写出相应反应的离子方程式
A→B:,B→C:,
(3)向B的溶液中滴加NaOH溶液,可观察到白色沉淀产生,该沉淀在空气中放置的现象为,发生上述变化的化学方程式为
在AlCl3溶液中滴加少量NaOH溶液,现象为_______________,所发生反应的离子方程式为_________________________________,继续加入过量的NaOH溶液,现象为_______________,所发生反应的离子方程式为__________________________________。
将一小块钠投入CuSO4溶液中,观察到的现象是__________(填序号)。
①钠浮于液面上;②熔化成小球;③发出嘶嘶的响声,放出气体;④有蓝色沉淀产生;⑤析出大量红色的铜。用离子方程式解释实验现象_________________________________________________